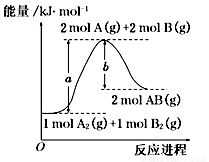
题目内容
下列热化学方程式书写正确的
A. 甲烷的燃烧热为-890 kJ/mol,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)=CO2(g)+ 2H2O(g)△H=-890 kJ/mol
B. 在一定条件下将1 molSO2和0.5molO2置于密闭容器中充分反应,放出热量79.2kJ,则反应的热化学方程式为:2SO2(g)+O2(g) 2SO3(g) △H=-158.4kJ·mol-1
2SO3(g) △H=-158.4kJ·mol-1
C. NaOH(s)+1/2H2SO4(浓)=1/2Na2SO4(aq)+H2O(l) △H=-57.3kJ·mol-1
D. 2.00gC2H2气体完全燃烧生成液态水和二氧化碳气体放出99.6kJ的热量,该反应的热化学方程式为:2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H=-2589.6kJ·mol-1
练习册系列答案
相关题目


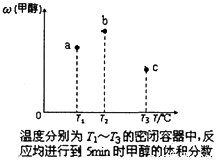
 CH3OH(g) △H。
CH3OH(g) △H。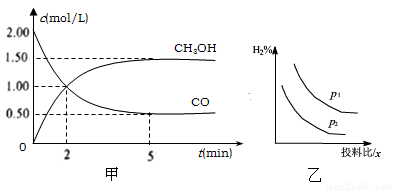
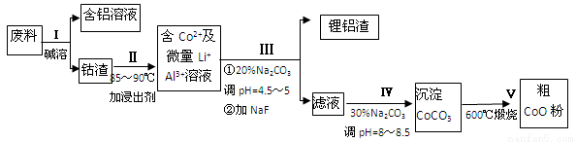
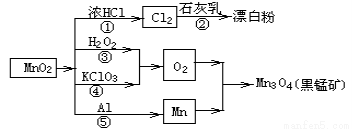


 、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。
、Cl-等,其中HClO2和ClO2都具有漂白作用。经测定,25℃时各组分含量随pH变化情况如图所示(Cl-没有画出)。则使用该漂白剂的适宜pH________(填“大于”“ 等于”或“小于”)3。