题目内容
【题目】石油气“芳构化”是由石油气生产高辛烷值汽油的一种有效生产工艺。测得反应2C4H10![]() C8H10(g)+5H2在不同温度下的平衡常数变化如下:
C8H10(g)+5H2在不同温度下的平衡常数变化如下:
温度(℃) | 400 | 450 | 500 |
平衡常数K | a | 6a | 40a |
(1)该反应的正反应是________(填“吸热”或“放热”)反应。
(2)向2 L密闭定容容器中充入2 mol C4H10,反应10 s后测得H2浓度为1 mol·L-1,此10 s内,以C8H10表示的平均速率为____________________。
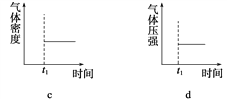
(3)能表示该反应在恒温恒容密闭容器中t1时刻后已经达平衡状态的图示是__________。

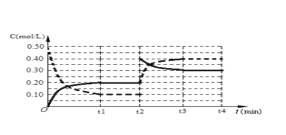
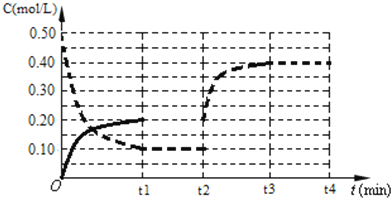
(4)下图表示某温度时将一定量的C4H10(含少量H2)充入容器中反应期间物质浓度随时间的变化(容器容积可变),实线代表C8H10,虚线代表C4H10。请用实线补充画出t1~t4间C8H10的浓度变化曲线。_____________
【答案】 吸热 0.02 b d 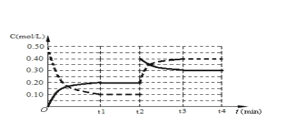
【解析】(1)图表数据,平衡常数随温度升高增大,平衡正向进行,正反应是吸热反应;(2)向2L密闭定容容器中充入2mol C4H10,反应10s后测得H2浓度为1mol/L,2C4H10 ![]() C8H10(g)+5H2,反应过程中生成C8H10的物质的量浓度为
C8H10(g)+5H2,反应过程中生成C8H10的物质的量浓度为![]() ×1mol/L=0.2mol/L,此10s内,以C8H10表示的平均速率=
×1mol/L=0.2mol/L,此10s内,以C8H10表示的平均速率=![]() =0.02mol/(Ls);(3)2C4H10
=0.02mol/(Ls);(3)2C4H10![]() C8H10(g)+5H2,反应是气体体积增大的吸热反应,依据平衡移动原理分析图象;a、反应前后都是气体,气体质量在反应过程中和平衡状态都始终不变,不能说明反应达到平衡状态,选项a不符合;b、反应前后气体质量不变,物质的量增大,平均摩尔质量不变说明反应达到平衡状态,选项b符合;c、气体质量不变,体积不变,密度在反应过程中和平衡状态都不变,选项c不符合;d、反应前后气体物质的量变化,压强之比等于气体物质的量之比,物质的量不变压强不变,说明反应达到平衡,选项d符合;答案选b、d;(4)分析图象可知,刚开始因为达到平衡状态,所以浓度不变,后面体积缩小为原来的
C8H10(g)+5H2,反应是气体体积增大的吸热反应,依据平衡移动原理分析图象;a、反应前后都是气体,气体质量在反应过程中和平衡状态都始终不变,不能说明反应达到平衡状态,选项a不符合;b、反应前后气体质量不变,物质的量增大,平均摩尔质量不变说明反应达到平衡状态,选项b符合;c、气体质量不变,体积不变,密度在反应过程中和平衡状态都不变,选项c不符合;d、反应前后气体物质的量变化,压强之比等于气体物质的量之比,物质的量不变压强不变,说明反应达到平衡,选项d符合;答案选b、d;(4)分析图象可知,刚开始因为达到平衡状态,所以浓度不变,后面体积缩小为原来的![]() (根据虚线的浓度变化可知),所以实线浓度也变为两倍,浓度变化为0.40mol/L,随反应进行后面又慢慢减小,直至继续平衡,据此画出的图象为:
(根据虚线的浓度变化可知),所以实线浓度也变为两倍,浓度变化为0.40mol/L,随反应进行后面又慢慢减小,直至继续平衡,据此画出的图象为: