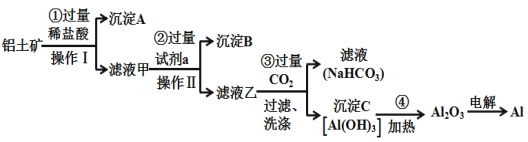
题目内容
【题目】Ⅰ.室温下,将一元酸HA的溶液和KOH溶液等体积混合(忽略混合后溶液的体积变化),实验数据如下表:
实验序号 | 起始浓度/(mol·L-1) | 反应后溶液的pH | |
c(HA) | c(KOH) | ||
① | 0.1 | 0.1 | 9 |
② | x | 0.2 | 7 |
请回答:
(1)HA溶液和KOH溶液反应的离子方程式为_____。
(2)下列关于反应后的溶液说法不正确的是____(填字母)。
a.实验②反应后溶液中只存在着两个平衡
b.实验②反应后溶液中:c(A-)+c(HA)>0.1mol·L-1
c.实验②反应后溶液中:c(K+)=c(A-)>c(OH-)=c(H+)
d. 实验①反应后的溶液中由水电离出的c(OH-)=10-9mol·L-1;x>0.2mol·L-1
Ⅱ.已知2H2(g)+O2(g)=2H2O(1) ΔH=-572kJ·mol-1。某氢氧燃料电池以疏松多孔石墨棒为电极,KOH溶液为电解质溶液。
(3)写出该电池工作时负极的电极反应式____。
(4)若该氢氧燃料电池每释放228.8kJ电能时,会生成1mol液态水,则该电池的能量转化率为____。
【答案】HA+OH-=A-+H2O a d H2+2OH--2e-=2H2O )80%
【解析】
(1)HA溶液和KOH溶液反应生成水和KA,据此书写离子反应方程式;
(2)a、HA为弱酸中A-存在电离平衡和水解平衡,水存在电离平衡,据此进行分析;
b、溶液中存在电荷守恒,即c(K+)+c(H+)=c(A-)+c(OH-),溶液呈中性,即c(OH-)=c(H+),则c(K+)=c(A-),所以c(A-)+c(HA)>c(K+),据此进行分析;
c、据电荷守恒进行分析;
d、反应①结束后,溶液中溶质为KA,会促进水的电离;实验②结束后溶液为中性,说明酸过量;
(3)负极失去电子方式氧化反应,据此进行分析;
(4)根据热化学反应方程式计算生成1mol水放出的能量,再利用燃料电池释放228.8kJ电能来计算电池的能量转化率。
(1)HA溶液和KOH溶液反应生成水和HA,故化学方程式为HA+KOH=KA+H2O,故离子反应方程式为HA+OH===A+H2O,
(2)a、实验②反应后溶液中有HA和KA两种溶质,HA为弱酸、存在电离平衡,A存在水解平衡,水存在电离平衡,故溶液中存在着三个平衡而不是两个平衡,故a选;
b、实验②反应后溶液中存在电荷守恒,即c(K+)+c(H+)=c(A)+c(OH),溶液呈中性,即c(OH)=c(H+),则c(K+)=c(A),所以c(A)+c(HA)>c(K+),c(K+)=0.5c(KOH)=0.1mo1L1,则c(A)+c(HA)>0.1mo1L1,故b不选;
c、溶液中存在电荷守恒,即c(K+)+c(H+)=c(A)+c(OH),溶液呈中性,即c(OH)=c(H+),则c(K+)=c(A),溶液呈中性,KA为强碱弱酸盐,显碱性,要想使溶液呈中性,则增加HA的浓度,即c(K+)=c(A)>c(OH)=c(H+),故c不选;
d、反应①结束后,溶液中溶质为KA,A-水解会促进水的电离,溶液中c(H+)=10-9mol/L,故c(OH-)水=c(OH-)=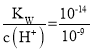 =10-5mol/L;反应②结束后,pH=7,即HA过量,即x>0.2;故d选;故答案为:ad;
=10-5mol/L;反应②结束后,pH=7,即HA过量,即x>0.2;故d选;故答案为:ad;
(3)负极失去电子方式氧化反应,故电极反应方程式为H2+2OH2e=2H2O;
(5)由2H2(g)+O2(g)═2H2O(I) △H=572kJ·mol1可知,生成1mol水时放出的热量为572KJ×0.5=286kJ,则电池的能量转化率为为![]() ×100%=80%。
×100%=80%。