题目内容
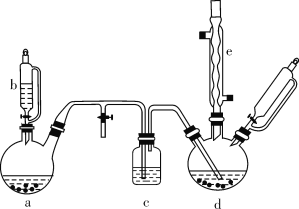
【题目】氯苯在染料、医药工业中用于制造苯酚、硝基氯苯、苯胺、硝基酚等有机中间体。实验室中制备氯苯的装置如下图所示(其中夹持仪器及加热装置略去)。
请回答下列问题:
(1)仪器b的名称是____。仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。打开仪器b的活塞,使浓盐酸缓缓滴下,可观察到仪器a内的现象是___,用离子方程式表示产生该现象的原因: __。
(2)仪器d内盛有苯、FeCl3粉末固体,仪器a中生成的气体经过仪器c进入仪器d中。仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是___加热,其优点是__。
(3)该方法制备的氯苯中含有很多杂质,工业生产中,通过水洗除去FeCl3、HCl及部分Cl2,然后通过碱洗除去Cl2。碱洗后通过分液得到含氯苯的有机混合物,混合物成分及沸点如下表所示:
有机物 | 苯 | 氯苯 | 邻二氯苯 | 间二氯苯 | 对二氯苯 |
沸点/℃ | 80 | 132.2 | 180.4 | 173.0 | 174.1 |
从该有机混合物中提取氯苯时,采用蒸馏的方法,收集____℃左右的馏分。
(4)实际工业生产中,苯的流失如下表所示:
流失项目 | 蒸气挥发 | 二氯苯 | 其他 | 合计 |
苯流失量(kg/t) | 28.8 | 14.5 | 56.7 | 100 |
某一次投产加入13 t苯,则制得氯苯____t(保留一位小数)。
【答案】滴液漏斗(或恒压分液漏斗)有黄绿色气体生成2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O水浴受热均匀,易于控制温度132.216.9
【解析】
(1)根据装置图可知,仪器b的名称是滴液漏斗或恒压分液漏斗;仪器a中盛有KMnO4晶体,仪器b盛有浓盐酸。利用高锰酸钾的强氧化性,能将氯离子氧化为氯气,发生反应2KMnO4+16HCl(浓)===2MnCl2+5Cl2↑+8H2O,可观察到仪器a内的现象是有黄绿色气体生成,反应的离子方程式为:2MnO4-+10Cl-+16H+===2Mn2++5Cl2↑+8H2O;(2)仪器d中的反应进行过程中,保持温度在40~60 ℃,以减少副反应发生。仪器d的加热方式最好是水浴加热,其优点是受热均匀,易于控制温度;(3)实验室制备氯苯,根据混合物沸点数据,因此收集132.2℃左右的馏分;(4)1 t损失苯100kg,则13 t苯损失苯![]() ,有(13-1.3)t苯生成氯苯,因此氯苯的质量为(13-1.3)
,有(13-1.3)t苯生成氯苯,因此氯苯的质量为(13-1.3)![]() t=16.9t。
t=16.9t。