��Ŀ����
����Ŀ��ij��ѧ��ȤС�����ʵ��̽����̽��̼����Ԫ�صķǽ����Ե����ǿ����ʵ��װ�����£������Ҫ��ش�����������
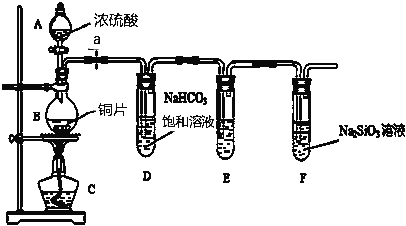
��1����д��ʾ��������A____________
��2��ʵ�鲽��������������__________________����ҩƷ��a��Ȼ�����Ũ���ᣬ����
��3������̽��������֪����ǿ���������̼�ᣩ
��ͭ��Ũ���ᷴӦ�Ļ�ѧ����ʽ��_________________________________________________��
װ��E��ʢ��������KMnO4��Һ��������__________________________.
�ڸ�ʵ��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ��������__________________��
��д��F �з�����Ӧ�����ӷ���ʽ________________________.
�������Թ�D�еķ����ķ�Ӧ���ܷ�֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ�����______����������������������ԭ����_______________________________________________________________��
���𰸡� ��Һ©�� ����װ�������� Cu+2H2SO4��Ũ![]() CuSO4+SO2��+2H2O ��ȥ������������ ǿ����ȡ���� CO2+SiO32��+H2O=H2SiO3��+CO32�� �� ���������Ԫ�ص�����������ˮ�����SO2����S������������
CuSO4+SO2��+2H2O ��ȥ������������ ǿ����ȡ���� CO2+SiO32��+H2O=H2SiO3��+CO32�� �� ���������Ԫ�ص�����������ˮ�����SO2����S������������
����������1������װ��ͼ��֪������A�����Ƿ�Һ©������2�����ڸ�ʵ�������������ʲμӷ�Ӧ�����ʵ�鲽�����������������������װ�������Ժ��ټ�ҩƷ��a��Ȼ�����Ũ���ᣬ���ȡ���3����ͭ��Ũ�����ϼ��ȣ�������Ӧ��������ͭ�����������ˮ����Ӧ�Ļ�ѧ����ʽ��Cu+2H2SO4(Ũ)![]() CuSO4+SO2��+2H2O����������������Ա�̼��ǿ�����Է�Ӧ������SO2������װ��D�ı���̼������Һ������Ӧ����CO2���壬SO2���л�ԭ�ԣ�E��ʢ��������KMnO4��Һ�������dz�ȥCO2������δ��Ӧ��SO2����ֹ����CO2�����ʣ��ڸ�ʵ��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ���������������ԣ�̼��ȹ���ǿ����������̼ͨ���������Һ�У�������Ӧ��CO2+SiO32��+H2O��H2SiO3��+CO32��֤����������SԪ������ϼ���+6�ۣ�����������SԪ����+4�ۣ����Բ��������Թ�D�з����ķ�Ӧ��֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ����ԡ�
CuSO4+SO2��+2H2O����������������Ա�̼��ǿ�����Է�Ӧ������SO2������װ��D�ı���̼������Һ������Ӧ����CO2���壬SO2���л�ԭ�ԣ�E��ʢ��������KMnO4��Һ�������dz�ȥCO2������δ��Ӧ��SO2����ֹ����CO2�����ʣ��ڸ�ʵ��֤��̼Ԫ�صķǽ����Աȹ�Ԫ�طǽ�����ǿ��ʵ���������������ԣ�̼��ȹ���ǿ����������̼ͨ���������Һ�У�������Ӧ��CO2+SiO32��+H2O��H2SiO3��+CO32��֤����������SԪ������ϼ���+6�ۣ�����������SԪ����+4�ۣ����Բ��������Թ�D�з����ķ�Ӧ��֤����Ԫ�صķǽ�����ǿ��̼Ԫ�صķǽ����ԡ�

 ����������ϵ�д�
����������ϵ�д� �Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�
�Ż���ҵ�Ϻ��Ƽ����׳�����ϵ�д�����Ŀ����25��ʱ���ܱ�������X��Y��Z��������ij�ʼŨ�Ⱥ�ƽ��Ũ�����±���
���� | X | Y | Z |
��ʼŨ��(mol��L��1) | 0.1 | 0.2 | 0 |
ƽ��Ũ��(mol��L��1) | 0.05 | 0.05 | 0.1 |
����˵��������� (�� ��)
A. ��Ӧ��ƽ��ʱ��X��ת����Ϊ50%
B. ��Ӧ�ɱ�ʾΪ��X��3Y![]() 2Z����ƽ�ⳣ��Ϊ1600
2Z����ƽ�ⳣ��Ϊ1600
C. ����ѹǿʹƽ��������Z�ķ����ƶ���ƽ�ⳣ������
D. �ı��¶ȿ��Ըı�˷�Ӧ��ƽ�ⳣ��
����Ŀ�����к͵ζ����ⶨ�ռ�Ĵ��ȣ����ռ��в��������ᷴӦ�����ʣ��Ը���ʵ��ش�
��1��ȷ��ȡ4.1g�ռ���Ʒ��
��2������Ʒ���250mL����Һ����Ҫ����������С�ձ�������������Ͳ����Ҫ____________________��
��3��ȡ10.00mL����Һ����___________________ ��ȡ��
��4����0.2010mol��L-1������ζ������ռ���Һ��������ָʾ�����ζ�ʱ������ת�ζ��ܵIJ������������ֲ�ͣ��ҡ����ƿ������ע��____________��������______________������ʱ������ζ��յ㡣
��5�������������ݣ���������ռ�Ĵ��ȣ�__________________����������λ��Ч���֣�
�ζ����� | ����Һ��� (mL) | �����������mL�� | |
�ζ�ǰ������mL�� | �ζ��������mL�� | ||
��һ�� | 10.00 | 0.50 | 20.40 |
�ڶ��� | 10.00 | 0.10 | 22.10 |
������ | 10.00 | 4.00 | 24.10 |
��6�����²�������ɲ������ƫ�ߵ�����_________��
��������ˮ��ϴ��ƿ��
���ڵζ������в�����������Һ������ƿ�⣻
�۶���ʱ���ζ�ǰ���ӣ��ζ����ӣ�
��װ��Һ֮ǰ��û���ñ�Һ��ϴ�ζ���;