题目内容
6.共价键、离子键和范德华力是微粒之间的不同作用力,下列物质中含有上述两种结合力的是( )①NaOH ②SiO2 ③NH4Cl ④金刚石 ⑤NaCl ⑥白磷.
| A. | ①③⑥ | B. | ①②④ | C. | ②④⑤ | D. | ③④⑤ |
分析 离子化合物一定存在离子键,可能存在共价键,共价化合物中只存在共价键,以共价键结合的物质可能为原子晶体,也可能为分子晶体,在分子晶体中还存在分子间作用力,据此解答.
解答 解:①NaOH是离子化合物,钠离子与氢氧根离子之间存在离子键,氧原子与氢原子之间存在共价键,故选;
②SiO2是共价化合物,只存在共价键,故不选;
③NH4Cl是离子化合物,铵根离子与氯离子直接存在离子键,氮原子与氢原子之间存在共价键,故选;
④金刚石是原子晶体,只有共价键,故不选;
⑤NaCl是离子化合物,只存在离子键,故不选; ⑥白磷存在P-P共价键,属于分子晶体,分子间通过分之间作用力结合,故选;
故选:A.
点评 本题考查化学键和晶体,注意化学键的形成规律及分子晶体中存在分子间作用力即可解答,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.用pH大小表示溶液的酸碱性相对强弱有许多不足之处.因此,荷兰科学家Henk Van Lubeck引入了酸度(AG)的概念,即把电解质溶液中的酸度定义为c(H+)与c(OH一)比值的对数,用公式表示为AG=lg[$\frac{c({H}^{+})}{c(O{H}^{-})}$].常温下,在AG=10的溶液中能大量共存的离子是( )
| A. | Ca2+、K+、Cl-、SO32- | B. | NH4+、Fe2+、I-、SO42- | ||
| C. | Na+、K+、ClO-、S2- | D. | Na+、S2O32-、AlO2-、K+ |
14.下列反应的离子方程式中,正确的是( )
| A. | 氯水与足量的 FeBr2溶液反应:2Fe2++4Br-+3Cl2=2Fe3++2Br2+6Cl- | |
| B. | NaHCO3溶液与 NaOH溶液反应:HCO3-+OH-=CO32-+H2O | |
| C. | NaHCO3溶液与盐酸反应:CO32-+2H+=CO2↑+H2O | |
| D. | NaHCO3溶液与CaCl2;溶液反应:CO32-+Ca2+=CaCO3↓ |
5.下列电离方程式中,正确的是( )
| A. | Fe(OH)3?Fe3++3OH- | B. | NaHCO3?Na++HCO3- | ||
| C. | KClO3═K++Cl-+3O2- | D. | H2S?2H++S2- |
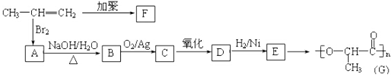
 .
.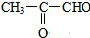 +2Cu(OH)2$\stackrel{△}{→}$
+2Cu(OH)2$\stackrel{△}{→}$ +Cu2O↓+2H2O.
+Cu2O↓+2H2O.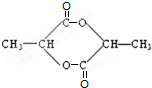 .
.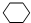 ,名称是环己烷,该烃的二氯代物有4种.
,名称是环己烷,该烃的二氯代物有4种.