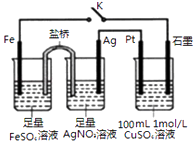
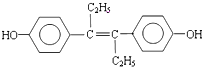
��Ŀ����
����Ŀ��ijͬѧ�����в�������100mL0.200molL��1Na2CO3��Һ����ش��й����⣮
ʵ�鲽�� | �й����� |
��1����������Na2CO3������ | ��ҪNa2CO3������Ϊ �� |
��2������Na2CO3���� | ����������Ӧ�õ�����Ҫ������ �� |
��3����Na2CO3����100mL�ձ��У�������������ˮ | Ϊ�˼ӿ��ܽ����ʣ�����ȡ�Ĵ�ʩ�� �� |
��4�����ձ��е���Һת��������A���Ѽ�鲻©ˮ���� | ����ת��Na2CO3��ҺǰӦ����Һ �� |
��5��������A�м�����ˮ���̶��� | �ڽ��д˲���ʱӦע��������� �� |
��6��ҡ�ȡ�װƿ������B�������ࡢ���� | ����B�� �� |
���۰������������Ƶ�Na2CO3��Һ��Ũ�� ��ѡ��ǡ����ǡ���0.200molL��1 �� ������ ��
���𰸡�2.12g��������ƽ�������ƽ���ò��������裻��ȴ�����£�100mL����ƿ���ò�����������������ˮ������ƿ�е�Һ��ӽ��̶���1��2cm�������ý�ͷ�ιܵμ�����Һ�İ�Һ��������̶�������|����ǩ������ǩ�����ǣ���Ϊ��ͬѧû��ϴ���ձ��Ͳ�����
���������⣺��1������100mL0.200molL��1Na2CO3��Һ����Ҫ����̼���Ƶ�����m=0.200mol/L��0.1L��106g/mol=2.12g�����Դ��ǣ�2.12g����2��������ƽ��ȷ��Ϊ0.1g��Ҫ�뾫ȷ�ȴﵽ0.01g��Ӧѡ�������ƽ�������ƽ�����Դ��ǣ�������ƽ�������ƽ����3��Ϊ�˼ӿ��ܽ����ʣ�����ȡ�Ĵ�ʩ���ò��������裻���Դ��ǣ��ò��������裻��4������ƿΪ��������������ʢ�Ź��ȡ�����Һ�壬��ҺʱӦ��ȴ�����£�����100mL��ҺӦѡ��100mL����ƿ������ƿƿ����ϸ����ҺʱΪ��ֹ��Һ������Ӧ��ȡ�Ĵ�ʩ���ò��������������Դ��ǣ�����ȴ�����£���100mL����ƿ�����ò�������������5������ʱ����ʼֱ�Ӽ�����ˮ������ƿ�е�Һ��ӽ��̶���1��2cm�������ý�ͷ�ιܵμ�����Һ�İ�Һ��������̶������У����Դ��ǣ�������ˮ������ƿ�е�Һ��ӽ��̶���1��2cm�������ý�ͷ�ιܵμ�����Һ�İ�Һ��������̶������У���6������һ�����ʵ���Ũ����Һһ�㲽�裺���㡢�������ܽ⡢��ȴ����Һ�����ݡ�ҡ�ȡ�����ǩ�����Դ��ǣ�����ǩ����ʵ��©��ϴ�Ӳ��������²���������ģ����ʵ����ʵ���ƫС������C= ![]() ��֪������������Һ��Ũ��С��0.200molL��1�����Դ��ǣ����ǣ���Ϊ��ͬѧû��ϴ���ձ��Ͳ�������
��֪������������Һ��Ũ��С��0.200molL��1�����Դ��ǣ����ǣ���Ϊ��ͬѧû��ϴ���ձ��Ͳ�������

 ȫ��������ϵ�д�
ȫ��������ϵ�д�