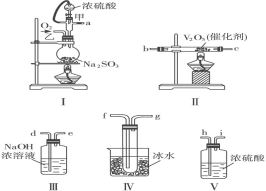
题目内容
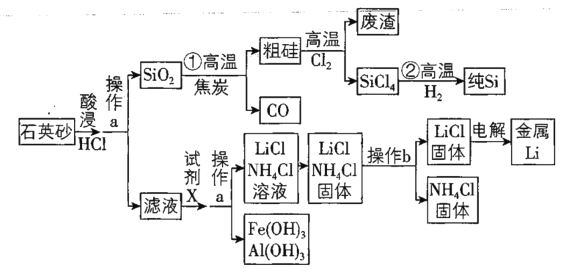
【题目】2018年8月31日,华为公司发布AI芯片麒麟980,标志着我国高科技企业的芯片制造技术迈入国际领先水平。组成芯片的核心物质是高纯度硅。下图是以石英砂为原料同时制备硅和金属锂的流程。![]() 石英砂的主要成分为
石英砂的主要成分为![]() ,含有少量
,含有少量![]() 、
、![]() 、
、![]()
已知:LiCl的熔点是![]() 、沸点是
、沸点是![]() ;
;![]() 在
在![]() 分解完全。常温下,
分解完全。常温下,![]() ,
,![]() 。
。
(1)粗硅中常含有副产物SiC,请写出![]() 中生成SiC的反应方程式__________。
中生成SiC的反应方程式__________。
(2)操作a为___________;试剂X是___________。
(3)已知操作b为加热,可选择的适宜温度是______
![]()
![]()
![]()
![]()
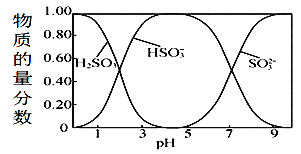
(4)本生产工艺要求,要控制LiCl和![]() 溶液中的杂质离子浓度在
溶液中的杂质离子浓度在![]() 以下,应控制溶液的pH为_____,此时溶液中
以下,应控制溶液的pH为_____,此时溶液中![]() 的浓度为___________ 。
的浓度为___________ 。
【答案】SiO2+3C![]() SiC+2CO↑ 过滤; 氨水
SiC+2CO↑ 过滤; 氨水 ![]()
![]()
![]()
【解析】
石英砂加入盐酸酸浸过滤得到二氧化硅和滤液,二氧化硅和碳高温反应生成粗硅,粗硅和氧气高温反应生成SiCl4和滤渣,SiCl4和H2高温反应得到纯硅,滤液加入试剂氨水过滤得到氢氧化铁、氢氧化铝沉淀和滤液LiCl溶液、NH4Cl溶液,蒸发结晶得到LiCl和NH4Cl固体,加热固体,氯化铵分解生成氨气和氯化氢气体,重新反应得到固体氯化铵,得到固体LiCl,电解熔融固体得到锂;
(1)①中生成SiC的反应是碳和二氧化硅反应生成碳化硅和一氧化碳;
(2)分析可知操作a为固体和溶液分离操作为过滤,生成氢氧化铁沉淀和氢氧化铝沉淀的试剂为氨水;
(3)根据已知条件中LiCl熔沸点和![]() 的分解温度分析判断;
的分解温度分析判断;
(4)结合溶度积常数计算。
石英砂加入盐酸酸浸过滤得到二氧化硅和滤液,二氧化硅和碳高温反应生成粗硅,粗硅和氧气高温反应生成SiCl4和滤渣,SiCl4和H2高温反应得到纯硅,滤液加入试剂氨水过滤得到氢氧化铁、氢氧化铝沉淀和滤液LiCl溶液、NH4Cl溶液,蒸发结晶得到LiCl和NH4Cl固体,加热固体,氯化铵分解生成氨气和氯化氢气体,重新反应得到固体氯化铵,得到固体LiCl,电解熔融固体得到锂;
(1)①中生成SiC的反应是碳和二氧化硅反应生成碳化硅和一氧化碳,反应的化学方程式:SiO2+3C ![]() SiC+2CO↑;
SiC+2CO↑;
(2)分析可知操作a为固体和溶液分离操作为过滤,流程图中沉淀生成的过程可知,沉淀离子的试剂X为氨水;
(3) ![]() 的熔点是
的熔点是![]() 、沸点是
、沸点是![]() ;
;![]() 在
在![]() 分解完全,操作b可选择的适宜温度是
分解完全,操作b可选择的适宜温度是![]() ;
;
(4)要控制杂质离子浓度在1.0×10-6mol/L以下,Ksp[Al(OH)3]=![]() ,
,![]() ,
,![]() ,pH=5.0,铝离子完全沉淀时,铁离子肯定完全沉淀,此时Ksp[Fe(OH)3]=
,pH=5.0,铝离子完全沉淀时,铁离子肯定完全沉淀,此时Ksp[Fe(OH)3]=![]() ,
,![]() 。
。

 文敬图书课时先锋系列答案
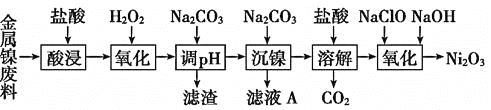
文敬图书课时先锋系列答案【题目】三氧化二镍![]() 是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料
是一种灰黑色无气味有光泽的块状物,易碎成细粉末,常用于制造高能电池。工业上以金属镍废料![]() 含有少量的铁、铝等杂质
含有少量的铁、铝等杂质![]() ,继而生产
,继而生产![]() 的工艺流程如下:
的工艺流程如下:
下表列出了相关金属离子生成氢氧化物沉淀的![]() 开始沉淀的pH按金属离子浓度为
开始沉淀的pH按金属离子浓度为![]() 计算
计算![]() 。
。
氢氧化物 |
|
|
|
|
开始沉淀的pH |
|
|
|
|
沉淀完全的pH |
|
|
|
|
(1)为了提高金属镍废料浸出的速率,在“酸浸”时可采取的措施有______
A. 降低温度 ![]() 搅拌
搅拌 ![]() 减少盐酸的浓度
减少盐酸的浓度 ![]() 将废料研成粉末
将废料研成粉末
(2)酸浸后的酸性溶液中加入![]() 的目的:__________。沉镍前需加
的目的:__________。沉镍前需加![]() 控制溶液pH范围为______,所得到滤渣的主要成分是_______。
控制溶液pH范围为______,所得到滤渣的主要成分是_______。
(3)从滤液A中可回收利用的主要物质是![]() 和________。
和________。
(4)“氧化”生成![]() 的离子方程式为__________________________。
的离子方程式为__________________________。
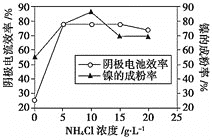
(5)工业上用镍为阳极,电解![]() 溶液与一定量
溶液与一定量![]() 组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,
组成的混合溶液,可得到高纯度、球形的超细镍粉。当其他条件一定时,![]() 的浓度对阴极电流效率及镍的成粉率的影响如图所示,则
的浓度对阴极电流效率及镍的成粉率的影响如图所示,则![]() 的浓度最好控制为_________。
的浓度最好控制为_________。