题目内容
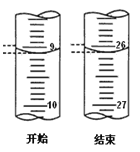
【题目】反应A(g)![]() B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
B(g) +C(g)在容积为1.0L的密闭容器中进行,A的初始浓度为0.050mol/L。温度T1和T2下A的浓度与时间关系如图所示。回答下列问题:
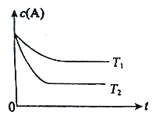
(1)上述反应的温度T1 T2(填“大于”、“小于”或“等于”)
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%, 则:
①平衡时体系总的物质的量为 。
②反应在0~5min区间的平均反应速率v(A)= 。
【答案】(1)小于 (2)①0.085mol ②0.007mol/(L·min) (每空2分,共6分)
【解析】试题分析:(1)根据图像可知T2温度下首先达到平衡状态,温度高反应速率快,因此温度是T1小于T2;
(2)若温度T2时,5min后反应达到平衡,A的转化率为70%, 则转化的A是0.050mol/L×1L×0.7=0.035mol。则
A(g)![]() B(g) +C(g)
B(g) +C(g)
起始量(mol) 0.05 0 0
转化量(mol) 0.035 0.035 0.035
平衡量(mol) 0.015 0.035 0.035
①平衡时体系总的物质的量为0.05mol+0.05mol+0.05mol=0.085mol。
②反应在0~5min区间的平均反应速率v(A)=0.035mol/L÷5min=0.007mol/(L·min)。

练习册系列答案
相关题目