题目内容
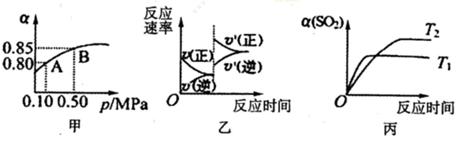
已知反应:2SO2(g)+ O2(g)  2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
 2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
2SO3(g).某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
| A.由图甲推断,B点SO2的平衡浓度为0.3mol·L-1 |
| B.由图甲推断,A点对应温度下的平衡常数为80 |
| C.达平衡后,缩小容器容积,则反应速率变化图像可以用图乙表示 |
| D.压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则△H<0 |
C
试题分析:A、B点SO2的平衡浓度为2×(1-0.85)÷10="0.03" mol·L-1,错误;
B、 2SO2(g)+ O2(g)
 2SO3(g)
2SO3(g)始量 2 1
转化量 1.6 0.8 1.6
平衡量 0.4 0.2 1.6
平衡常数k=0.162/0.042×0.02=800,错误。
C、达平衡后,缩小容器容积,增大压强平衡正向移动,正反应速率大于逆反应速率且均比原来大,正确;D、Tl反应速率快,温度高,SO2转化率低平衡逆向移动,反应放热。

练习册系列答案
相关题目
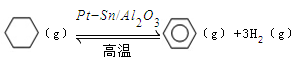 。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。
。某温度下,向恒容密闭容器中加入环己烷,起始浓度为a mol/L,平衡时苯的浓度为bmol/L,该反应的平衡常数K=_____。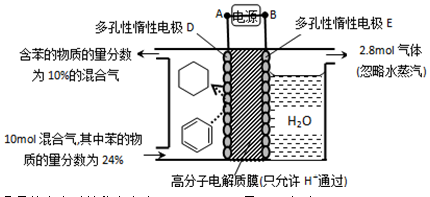
 =_____(
=_____( ×100%,计算结果保留小数点后1位)
×100%,计算结果保留小数点后1位) CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( )
CO2(g)+H2(g)△H<0反应达到平衡后,为提高CO的转化率,下列措施中正确的是( ) 2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )
2Z,达到平衡时,若它们的物质的量满足:n(X)+n(Y)=n(Z),则Y的转化率为 ( )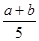 ×100%
×100%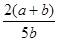 ×100%
×100%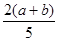 ×100%
×100%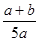 ×100%
×100% N2O4△H=—56.9kJ/mol下列分析不正确的是
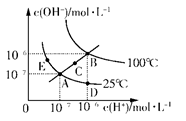
N2O4△H=—56.9kJ/mol下列分析不正确的是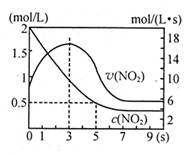
 CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是
CO(g)+Cl2(g) △H>0 当反应达到平衡时,下列措施:①升温 ②恒容通入惰性气体 ③增加CO的浓度 ④减压 ⑤加催化剂 ⑥恒压通入惰性气体,能提高COCl2转化率的是