题目内容
【题目】下列有机物是按照碳骨架进行分类的是 ( )
A.烷烃B.烯烃
C.芳香族化合物D.卤代烃
【答案】C
【解析】
A. 烷烃为分子中含有碳碳单键的烃(甲烷例外),属于饱和烃,是按照官能团种类进行分类,不是按照碳架分类的,故A错误;
B. 烯烃为分子中含有碳碳双键的烃,是按照官能团种类进行分类,不是按照碳架分类的,故B错误;
C. 芳香族化合物是含有苯环的化合物,属于环状化合物中的芳香化合物,是按照碳架分类的,故C正确;
D. 烃中氢原子被卤素原子取代后生成的化合物称为卤代烃,卤代烃是按照官能团种类分类的,故D错误;
故选C。

 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
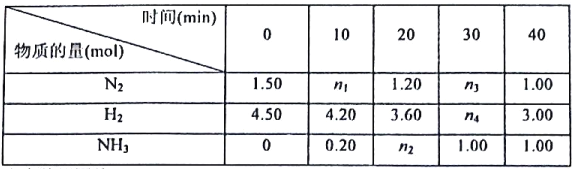
全能闯关100分系列答案【题目】法医常用马氏试砷法检验是否砒霜(As2O3)中毒,涉及的反应如下:
Ⅰ: 6Zn+As2O3+12HCl=6ZnCl2+2AsH3(砷烷) ↑+3H2O
Ⅱ: 2AsH3=2As(黑色砷镜)+3H2
(1)写出砷的基态原子价电子排布式__________
(2)砷烷的空间结构为_________;砷烷中心原子杂化方式为________
(3)砷烷同族同系列物质相关性质如下表:
NH3 | PH3 | AsH3 | SbH3 | |
熔点/℃ | -77.8 | -133.5 | -116.3 | -88 |
沸点/℃ | -34.5 | -87.5 | -62.4 | -18.4 |
从PH3![]() AsH3
AsH3![]() SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
SbH3,熔沸点依次升高的原因是______________________,NH3分子例外的原因是__________________________________.
(4)第一电离能数据I(As)____ I(Se)
(5)立方氮化硼(BN)是特殊的耐磨和切削材料,其晶胞结构与金刚石相似,如图所示。
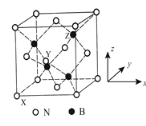
晶胞有两个基本要素:原子坐标参数,表示晶胞内部各原子的相对位置。如图b所示,其中原子坐标参数X为(0,0,0),Y原子的坐标参数为(1/2,0,1/2),则Z原子的坐标参数为________。晶胞参数,描述晶胞的大小和形状。已知立方氮化硼的密度为d gcm-3,阿伏加德罗常数值为NA,则晶胞参数a=________nm。(列出计算式即可)