题目内容
下列实验现象及结论正确的是( )
A.铜在氯气中燃烧,产生白色的烟;CuCl2为白色
B.CuCl2溶于水呈绿色:CuCl2为绿色
C.将Na放在燃烧匙中,在Cl2中燃烧时有棕色的烟:NaCl为棕色固体
D.H2在Cl2中燃烧,产生苍白色火焰,瓶口上方有白雾:产物HCI在空气中可生成白雾
D
解析:
铜粉在氯气中燃烧生成棕黄色的烟,CuCl2为棕黄色;将Na在Cl2中燃烧时有白色的烟,NaCl粉末为白色固体。

 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案(2013?河东区一模)下列选项中的实验及现象得出的结论不正确的是( )
|
I.类比法是化学学习中常用的方法,已知硝酸能把铁氧化成Fe(NO3)3,但当铁过量时,产物是 Fe(NO3)2。某同学受此启发,提出一个相似的观点:氯气与铁粉反应,当Cl2足量时生称FeCl3,当铁粉过量时产物是FeCl2,为了验证该观点是否正确,该同学将一定量的铁粉与Cl2恰好完全反应得到一固体物质,然后通过实验确定其成分。探究过程如下:
⑴提出假设:
假设1:该固体物质是FeCl2
假设2:该固体物质是FeCl3
假设3:该固体物质是
⑵设计实验方案:
取少量固体物质置于烧杯中,加适量水溶解,得到溶液A,然后取两份A溶液分别进行实验,实验现象与结论如下表:
实验方法 | 实验现象 | 结论 |
在溶液中加KSCN溶液 |
| 固体物质中有FeCl3 |
在KMnO4溶液中加少量A 溶液 | KmnO4溶液颜色无明显变化 | 固体物质中不含 |
Ⅱ.电子工业常用30%的FeCl3溶液腐蚀敷在绝缘版上的铜箔,制造印刷电路板。某工程师为了从废液中回收铜,重新获得FeCl3溶液,设计了下列实验步骤:

⑶①写出一个能证明还原性Fe比Cu强的离子方程式: ,该反应在上图步骤 中发生。
②甲、乙、丙、丁四位同学利用上述反应原理,分别设计的原电池如下图所示:


四位同学的设计的原电池装置图,符合上述反应原理的是 。
③请写出正、负极的电解反应式:
正极: 、负极: (电极反应式)。
⑷上述过程回收的铜是粗铜,为了获得更纯的铜必须进行电解精炼。写出电解精炼时阳极材料及电极反应式
下列选项中的实验及现象得出的结论不正确的是
| 实验 | 现象 | 结论 | |
| A |  | 试管(1)中紫色消失,试管(2)中紫色没有消失 | 甲苯中苯环使甲基的活性增强 |
| B |  | 试管内壁有银镜生成 | X具有还原性,一定含有醛基 |
| C |  | 先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 | Fe(OH)3是比Mg(OH)2更难溶的电解质 |
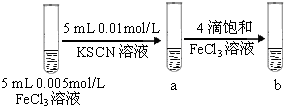
| D |  | 试管b比试管a中溶液的红色深 | 增大反应物浓度,平衡向正反应方向移动 |
- A.A
- B.B
- C.C
- D.D
 研究硫及其化合物性质有重要意义.
研究硫及其化合物性质有重要意义.






 试管内壁有
试管内壁有 先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 Fe(OH)3是比Mg(OH)2
先生成白色沉淀,滴加FeCl3溶液后,生成红褐色沉淀 Fe(OH)3是比Mg(OH)2 试管b 比试管a中溶液的红色深 增大反应物浓度,平衡向正反应方向移动
试管b 比试管a中溶液的红色深 增大反应物浓度,平衡向正反应方向移动