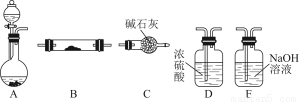
题目内容
某学习小组欲模拟从某工厂废液中回收丙酮、乙醇和乙酸的实验。制定了如下试验流程。
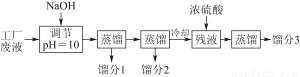
已知该废液中主要含有乙醇,其中还溶有丙酮、乙酸和乙酸乙酯。且各种成分的沸点如下表:
物质 | 丙酮 | 乙酸乙酯 | 乙醇 | 乙酸 |
沸点(℃) | 56.2 | 77.06 | 78 | 117.9 |
(1)馏分3的成分为____________。
(2)上述流程中调节pH=10的目的是________________________________________________________________________________________________________________________________________________。
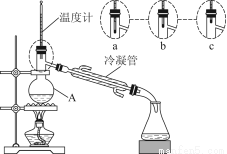
(3)该小组同学的蒸馏装置如图所示。则A中温度计的位置正确的是________(填“a”“b”或“c”)。
(4)国家标准规定,优质高度浓香型白酒总酸量(以乙酸计)应不少于0.30 g/L,总酯量(以乙酸乙酯计)应不少于2.0 g/L。
①为测定某白酒样品的总酸量,取20.00 mL样品于锥形瓶中,加入酚酞指示剂2滴,用0.010 mol/L的NaOH标准溶液滴定至终点。判断终点的依据是________________________________________________________________________________________________________________________________________________。
若该白酒样品为优质级,则消耗NaOH溶液体积应不小于________mL。
②白酒中的总酯量可用返滴法测定。往上题滴定后的溶液(恰好至终点)中再加入20.00mL0.100mol/L NaOH标准溶液,用图装置水浴加热半小时。冷却后用0.100mol/L的硫酸标准溶液滴定至终点。加热半小时的目的是______________________,冷凝管的作用是______________。已知最终消耗硫酸标准溶液7.70 mL,该白酒样品中总酯量为________g/L(保留小数点后三位数字)。
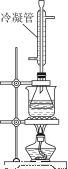
(5)下列操作会使总酯量测定结果偏高的是________(选填编号)
a.加热时未使用水浴和冷凝管
b.滴定前滴定管内无气泡,滴定后产生气泡
c.滴定管未用硫酸标准溶液润洗
(1)乙酸
(2)使乙酸生成乙酸钠;使乙酸乙酯在加热蒸馏时生成乙酸钠和乙醇(答成使乙酸乙酯水解也可)
(3)b
(4)①溶液由无色变为粉红色,半分钟内不褪色 10.00
②使酯水解完全 冷凝回流 2.024
(5)b
【解析】(1)~(2)该流程的原理为:首先加入NaOH溶液调节pH=10,使乙酸转化为难挥发的乙酸钠,同时,乙酸乙酯在加热蒸馏时也发生水解生成难挥发的乙酸钠和乙醇,这样在第一次蒸馏时可得丙酮和乙醇两种馏分;向残液中加入浓硫酸,发生反应2CH3COONa+H2SO4(浓)―→Na2SO4+2CH3COOH,再加热至118 ℃,收集馏出物,得乙酸。
(3)蒸馏装置温度计测量的是蒸出的蒸气的温度,故温度计的感温泡应置于蒸馏烧瓶支管口附近。
(4)①若为优质白酒,则其中醋酸的最小含量为0.30 g/L,其物质的量浓度为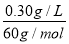 =0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
=0.005 0 mol·L-1;20.00×10-3 L×0.005 0 mol·L-1=0.010 mol·L-1×V,则V=0.010 L,即10 mL。
②该实验的原理是加入过量的氢氧化钠溶液加热使之充分水解,再用稀硫酸滴定过量的氢氧化钠,通过乙酸乙酯消耗的氢氧化钠的量来求出乙酸乙酯的量。n(CH3COOCH2CH3)=20.00×10-3 L×0.100 mol·L-1-7.70×10-3 L×2×0.100 mol·L-1=0.000 46 mol,故该白酒样品中总酯量为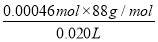 =2.024 g·L-1。
=2.024 g·L-1。
(5)加热时未使用冷凝管可导致乙酸乙酯蒸气逸出,使乙酸乙酯消耗氢氧化钠溶液体积偏小,造成结果偏小;滴定前滴定管内无气泡,滴定后产生气泡,滴定时消耗硫酸体积读数偏小,造成计算时乙酸乙酯消耗氢氧化钠溶液体积偏大,结果偏大;滴定管未用标准硫酸溶液润洗,滴定时消耗硫酸体积偏大,造成乙酸乙酯消耗氢氧化钠溶液体积偏小,结果偏小。

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案(1)某无色稀溶液X中,可能含有下表所列离子中的某几种。
阴离子 | CO32—、SiO32—、AlO2—、Cl- |
阳离子 | Al3+、Cu2+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂Y的体积(V)的关系如图所示。
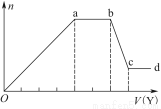
①若Y是盐酸,则溶液中含有的金属阳离子是_________________________________,
ab段发生反应的总离子方程式为___________________________________
表中Oa段与Y溶液反应的离子的物质的量之比为__________[要标明离子符号,如n(Na+)]。
②若Y是NaOH溶液,则bc段反应的离子方程式为______________________________
若不考虑离子的水解因素,忽略H+和OH-的影响,且溶液中只存在4种离子,则它们的离子个数比为___________________________________[按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列]。
(2)锡为第ⅣA族元素,锡的单质和化合物与某些物质的化学性质上有许多相似之处。已知锡元素具有如下性质:
Sn4++Sn=2Sn2+;
2Sn2++O2+4H+=2Sn4++2H2O;
2H++SnO22— Sn(OH)2
Sn(OH)2 Sn2++2OH-。
Sn2++2OH-。
试回答:
①锡溶于盐酸,再向反应后的溶液中通入氯气,有关反应类似于铁的相应变化,试写出有关反应的离子方程式:______________________________________,
②将①中溶液蒸干后继续加热所得固体,变化过程类似于FeCl3溶液相应的变化,则最后得到的固体物质是(分子式)__________。
③若可用SnCl2溶液与过量的碱溶液反应的方法制Sn(OH)2, 该碱是__________。