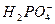题目内容
过氧化氢(H2O2)俗名双氧水,请按下列要求回答问题并计算:
(1)H2O2的电子式为 ;固态时H2O2为 晶体。
(2)向含有酚酞的Na2CO3溶液中滴入双氧水(H2O2),溶液由红色褪至无色;再向该溶液中加入足量的0.1mol·L-1的NaOH溶液,溶液始终不再显红色,主要原因是双氧水具有_________性。
(3)如果将9.60×10-4mol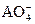 在溶液中还原成较低价态,需用0.100mol·L-1的H2O2溶液24.0mL,试通过计算确定A元素的最终价态。
在溶液中还原成较低价态,需用0.100mol·L-1的H2O2溶液24.0mL,试通过计算确定A元素的最终价态。
(1)H2O2的电子式为 ;固态时H2O2为 晶体。
(2)向含有酚酞的Na2CO3溶液中滴入双氧水(H2O2),溶液由红色褪至无色;再向该溶液中加入足量的0.1mol·L-1的NaOH溶液,溶液始终不再显红色,主要原因是双氧水具有_________性。
(3)如果将9.60×10-4mol
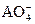 在溶液中还原成较低价态,需用0.100mol·L-1的H2O2溶液24.0mL,试通过计算确定A元素的最终价态。
在溶液中还原成较低价态,需用0.100mol·L-1的H2O2溶液24.0mL,试通过计算确定A元素的最终价态。 (1)H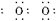 H分子
H分子
(2)氧化(或漂白)
(3)设A原子得n个电子,根据电子得、失总数相等列式:9.6×10-4·n=0.024×0.1×2(1个H2O2分子失2个电子),解得:n=5,则A元素由+7价得5个电子降为+2价。
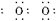 H分子
H分子(2)氧化(或漂白)
(3)设A原子得n个电子,根据电子得、失总数相等列式:9.6×10-4·n=0.024×0.1×2(1个H2O2分子失2个电子),解得:n=5,则A元素由+7价得5个电子降为+2价。
水分子的电子式为H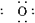 H,根据水分子的电子式推断并写出过氧化氢的电子式,要注意在H2O2分子中有一个过氧键(—O—O—);固态时,H2O2与H2O一样,属于分子晶体;Na2CO3溶液呈碱性,加入酚酞后显红色,而滴入双氧水红色褪去,再加NaOH不显红色,说明H2O2具有强氧化性或漂白性,使有色基团的结构被氧化而改变,从而褪色;至于计算A元素的还原价态,首先应确定
H,根据水分子的电子式推断并写出过氧化氢的电子式,要注意在H2O2分子中有一个过氧键(—O—O—);固态时,H2O2与H2O一样,属于分子晶体;Na2CO3溶液呈碱性,加入酚酞后显红色,而滴入双氧水红色褪去,再加NaOH不显红色,说明H2O2具有强氧化性或漂白性,使有色基团的结构被氧化而改变,从而褪色;至于计算A元素的还原价态,首先应确定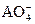 中A的化合价为+7,然后按得、失电子总数相等,列式求出A原子所得电子数,即可确定A元素的最终价态,反应中H2O2被氧化生成O2。
中A的化合价为+7,然后按得、失电子总数相等,列式求出A原子所得电子数,即可确定A元素的最终价态,反应中H2O2被氧化生成O2。
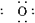 H,根据水分子的电子式推断并写出过氧化氢的电子式,要注意在H2O2分子中有一个过氧键(—O—O—);固态时,H2O2与H2O一样,属于分子晶体;Na2CO3溶液呈碱性,加入酚酞后显红色,而滴入双氧水红色褪去,再加NaOH不显红色,说明H2O2具有强氧化性或漂白性,使有色基团的结构被氧化而改变,从而褪色;至于计算A元素的还原价态,首先应确定
H,根据水分子的电子式推断并写出过氧化氢的电子式,要注意在H2O2分子中有一个过氧键(—O—O—);固态时,H2O2与H2O一样,属于分子晶体;Na2CO3溶液呈碱性,加入酚酞后显红色,而滴入双氧水红色褪去,再加NaOH不显红色,说明H2O2具有强氧化性或漂白性,使有色基团的结构被氧化而改变,从而褪色;至于计算A元素的还原价态,首先应确定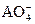 中A的化合价为+7,然后按得、失电子总数相等,列式求出A原子所得电子数,即可确定A元素的最终价态,反应中H2O2被氧化生成O2。
中A的化合价为+7,然后按得、失电子总数相等,列式求出A原子所得电子数,即可确定A元素的最终价态,反应中H2O2被氧化生成O2。
练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
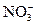 ="===3" Cu2++2NO↑+4H2O
="===3" Cu2++2NO↑+4H2O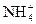 +H2O
+H2O