题目内容
【题目】T ℃时,在2 L密闭容器中使X(g)与Y(g)发生反应生成Z(g)。反应过程中X、Y、Z的物质的量的变化如图1所示;若保持其他条件不变,温度分别为T1和T2时,Z的百分含量与时间的关系如图2所示。则下列结论正确的是
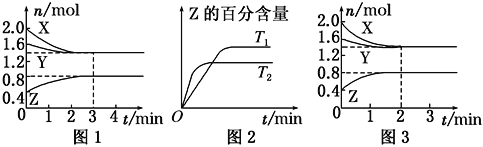
A. 容器中发生的反应可表示为3X(g)+Y(g) ==2Z(g)
B. 反应进行的前3 min内,用X表示的反应速率v(X)=0.2 mol·L-1·min-1
C. 若改变反应条件,使反应进程如图3所示,则改变的条件是增大压强
D. 保持其他条件不变,升高温度,反应的化学平衡常数K减小
【答案】D
【解析】
A.由图1知,X的物质的量减少量为(2.0-1.4)mol=0.6mol,Y的物质的量减少量为(1.6-1.4)mol=0.2mol,X、Y为反应物;Z的物质的量增加量为(0.8-0.4)mol=0.4mol,Z为生成物,同一化学反应同一时间段内,反应物减少的物质的量和生成物增加的物质的量之比等于其计量数之比,所以X、Y、Z的计量数之比=0.6mol:0.2mol:0.4mol=3:1:2,该反应为可逆反应,所以反应可表示为:3X(g)+Y(g)2Z(g),故A错误;
B.v(X)= ![]() =
= ![]() =
=![]() =0.1mol/(L
=0.1mol/(L![]() min),故B错误;
min),故B错误;
C.图3与图1比较,图3到达平衡所用的时间较短,说明反应速率增大,但平衡状态没有发生改变,应是加入催化剂所致,故C错误;
D.由图2知,“先拐平数值大”,所以T 2 >T 1 ,升高温度Z的百分含量减少,平衡向逆反应方向移动,即生成物的浓度减小反应物的浓度增大,所以平衡常数减小,故D正确。
故答案选D。

练习册系列答案
相关题目