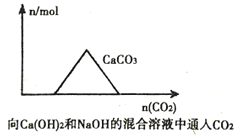
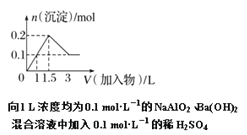
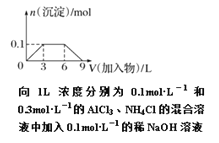
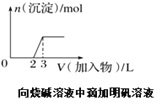
题目内容
【题目】下列说法正确的是
A.P4和CH4的空间构型和键角都相同
B.O3与OF2都是V形分子
C.SO3和SeO32-的立体构型都是三角锥形
D.HOCH2CH(OH)CH2OH与CH3CHClCH2CH3都是手性分子
【答案】B
【解析】
试题分析:A.P4与CH4都是正四面体结构,键角分别为60℃、109°28′,两者不同,故A错误;B.O3中O原子形成2个σ键,孤对电子数为![]() (6-2×2)=1,所以立体构型为V型,OF2中O原子的价层电子对数为2+
(6-2×2)=1,所以立体构型为V型,OF2中O原子的价层电子对数为2+![]() (6-2×1)=4,含有2个孤电子对,分子结构属于V形,故B正确;C.在SO3分子中,硫原子周围的价电子对数为3+
(6-2×1)=4,含有2个孤电子对,分子结构属于V形,故B正确;C.在SO3分子中,硫原子周围的价电子对数为3+![]() (6-3×2)=3,所以SO3的立体构型为平面三角形,在SeO32-的中硒原子周围的价电子对数为3+
(6-3×2)=3,所以SO3的立体构型为平面三角形,在SeO32-的中硒原子周围的价电子对数为3+![]() (6+2-3×2)=4,所以SeO32-的立体构型为三角锥形,故C错误;D.CH3CHClCH2CH3是手性分子,HOCH2CH(OH)CH2OH不是手性分子,故D错误;故选B。
(6+2-3×2)=4,所以SeO32-的立体构型为三角锥形,故C错误;D.CH3CHClCH2CH3是手性分子,HOCH2CH(OH)CH2OH不是手性分子,故D错误;故选B。

 华东师大版一课一练系列答案
华东师大版一课一练系列答案【题目】(1)含碳物质不完全燃烧会产生CO。血红蛋白中含有Fe2+,CO易与血红蛋白结合成稳定的配合物而使人中毒,写出铁离子(Fe3+)的核外电子排布式为_____________,CO有多种等电子体,其中常见的一种分子是__________。利用CO可以合成化工原料COCl2、配合物Fe(CO)5等,已知一个COCl2分子中每个原子最外层都形成8电子的稳定结构,则一个COCl2分子内含有_____个δ键,C原子的杂化方式为__________。Fe(CO)5等在一定条件下分解生成CO和铁,反应过程中断裂的化学键是__________,形成的化学键是___________。
(2)A、B均为短周期金属元素。依据下表数据,回答问题:
电离能/kJ·mol-1 | I1 | I2 | I3 | I4 |
A | 932 | 1821 | 15390 | 21771 |
B | 738 | 1451 | 7733 | 10540 |
写出A原子的电子排布图_______________,Al原子的第一电离能_____(填:“大于”、“小于”或“等于”)738 kJ·mol-1,原因是_________________。