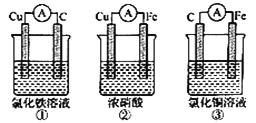
题目内容
【题目】某温度下,向10mL0.1 mol/L的醋醵溶液中逐滴加入等浓度的NaOH溶液,溶液中pH与pOH[pOH=-lgc (OH-)]的变化关系如图所示。则下列说法正确的是
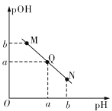
A. 两者恰好反应完全,需要NaOH溶液的体积大于10mL
B. Q点时溶液的pH=7
C. M点时溶液呈碱性,对水的电离起抑制作用
D. N点所示溶液中,c(CH3COO-)>c(CH3COOH)
【答案】D
【解析】A.两者恰好反应完全,醋酸和氢氧化钠的物质的量相同;B、常温时,中性溶液的PH才为7;C、酸碱抑制水的电离;D、
A. 醋酸和氢氧化钠的物质的量相同,两者恰好反应完全,需要NaOH溶液的体积等于10mL,故A错误;B.Q点pOH=pH,说明c(H+)═c(OH-),溶液显中性,但温度末知, Q点时溶液的pH不一定为7,故B 错误;C. M点时溶液中溶质为醋酸和醋酸钠,呈酸性,对水的电离起抑制作用,故C错误;D. N点所示溶液中,溶质为醋酸钠和过量的氢氧化钠,溶液中离子以CH3COO-为主,水解产生的醋酸分子较少,故c(CH3COO-)>c(CH3COOH),故D正确;故选D。

练习册系列答案
相关题目
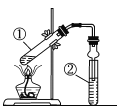
【题目】利用下图实验装置进行有关实验,下列对结论的叙述正确的是
选项 | ①中试剂 | ②中试剂 | 结论 |
|
A | 镁条、蒸馏水 | 肥皂水 | ②中开始出现气泡,说明①中生成了氢气 | |
B | 铜片、硝酸溶液 | 蒸馏水 | ②中试管口出现红棕色气体,说明①中生成了NO2 | |
C | 二氧化锰、浓盐酸 | 淀粉KI溶液 | 该装置可以用来检验①中是否产生了氯气 | |
D | 乙醇、乙酸、浓硫酸 | 饱和NaOH溶液 | 该装置可以用来制备乙酸乙酯 |
A. A B. B C. C D. D