题目内容
【题目】焦亚硫酸钠(Na2S2O5)是常用的抗氧化剂,在空气中、受热时均易分解.实验室制备少量Na2S2O5的方法:在不断搅拌下,控制反应温度在40℃左右,向Na2CO3过饱和溶液中通入SO2 , 实验装置如图所示. 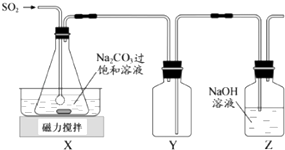
当溶液pH约为4时,停止反应.在20℃左右静置结晶.生成Na2S2O5的化学方程式为:2NaHSO3═Na2S2O5+H2O
(1)SO2与Na2CO3溶液反应生成NaHSO3和CO2 , 其离子方程式为 .
(2)装置Y的作用是
(3)析出固体的反应液经减压抽滤、洗涤、25℃﹣30℃干燥,可获得Na2S2O5固体.
①组成减压抽滤装置的主要仪器是布氏漏斗、和抽气泵.
②依次用饱和SO2水溶液、无水乙醇洗涤Na2S2O5固体.用饱和SO2水溶液洗涤的目的是 .
(4)实验制得的Na2S2O5固体中含有一定量的Na2SO3和Na2SO4 , 其可能的原因是
【答案】
(1)2SO2+CO32﹣+H2O=2HSO3﹣+CO2
(2)防止倒吸
(3)吸滤瓶;减少Na2S2O5在水中的溶解
(4)在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4
【解析】解:(1)向Na2CO3过饱和溶液中通入SO2 , 发生反应生成NaHSO3和CO2 , 反应的离子方程式为2SO2+CO32﹣+H2O=2HSO3﹣+CO2 ,
所以答案是:2SO2+CO32﹣+H2O=2HSO3﹣+CO2;(2)二氧化硫易溶于氢氧化钠溶液,Y为安全瓶,可防止倒吸,所以答案是:防止倒吸;(3)①组成减压抽滤装置的主要仪器是布氏漏斗、吸滤瓶和抽气泵,所以答案是:吸滤瓶;②由反应2NaHSO3═Na2S2O5+H2O可知,增大HSO3﹣的浓度,有利于生成Na2S2O5 , 用饱和SO2水溶液洗涤,可降低Na2S2O5的溶解度,减少Na2S2O5的溶解,
所以答案是:减少Na2S2O5在水中的溶解;(4)Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化,可知验制得的Na2S2O5固体中含有一定量的Na2SO3 和Na2SO4 ,
所以答案是:在制备过程中Na2S2O5易分解生成Na2SO3 , 且Na2SO3易被氧化生成Na2SO4 .

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案