题目内容
【题目】常温下,向20.00mL 0.100molL﹣1 CH3COONa溶液中逐滴加入0.100 0molL﹣1盐酸,溶液的pH与所加盐酸体积的关系如图所示(不考虑挥发).下列说法正确的( ) 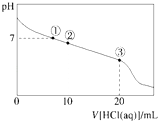
A.点①所示溶液中:c(CH3COOH)=c(Cl﹣)>c(OH﹣)=c(H+)
B.点②所示溶液中:c(Na+)>c(Cl﹣)>c(CH3COO﹣)>c(CH3COOH)
C.点③所示溶液中:c(CH3COOH)>c(Na+)>c(H+)>c(CH3COO﹣)
D.整个过程中可能出现:c(H+)+c(Na+)═c(CH3COOH)+c(CH3COO﹣)
【答案】A
【解析】解:A.溶液存在电荷守恒c(H+)+c(Na+)=c(OH﹣)+c(CH3COO﹣)+c(Cl﹣)和物料守恒c(Na+)=c(CH3COOH)+c(CH3COO﹣),点①溶液pH=7,二者联式可得c(CH3COOH)=c(Cl﹣),故A正确;B.点②时,加入盐酸10mL,溶液中存在CH3COONa和CH3COOH,溶液呈酸性,说明CH3COOH电离大于CH3COO﹣水解,应有c(CH3COO﹣)>c(Cl﹣),故B错误;
C.点③时,恰好反应生成CH3COOH,CH3COOH为弱电解质,不完全电离,溶液呈酸性,则c(Na+)>c(CH3COOH)>c(H+)>c(CH3COO﹣),故C错误;
D.溶液中存在物料守恒:c(Na+)=c(CH3COOH)+c(CH3COO﹣),故D错误;
故选A.

 名校课堂系列答案
名校课堂系列答案【题目】一定温度下,在容积为2L的密闭容器中发生反应CO(g)+H2O(g)CO2(g)+H2(g),部分数据见表(表中t2>t1):下列说法错误的是( )
反应时间/min | n(CO)/mol | n(H2O)/mol | n(CO2)/mol | n(H2)/mol |
0 | 1.20 | 0.60 | 0 | 0 |
t1 | 0.80 | |||
t2 | 0.20 |
A.反应在t1 min末的速率为v(H2)= ![]() ?mol?L﹣1?min﹣1
?mol?L﹣1?min﹣1
B.平衡时水蒸气的转化率为66.67%
C.该温度下反应的平衡常数为1
D.其他条件不变,若起始时n(C0)=0.60 mol,n(H20)=1.20 mol,则平衡时水蒸气的转化率为33.33%