题目内容
【题目】(1)化合物SOCl2是一种液态化合物,沸点为77℃,在盛有10mL水的锥形瓶中小心滴加8~10滴SOCl2,可观察到剧烈水解反应,液面有白雾和带有刺激性气味的气体逸出,该气体可使滴有品红试液的滤纸褪色。轻轻振荡锥形瓶,等白雾消失后,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出。
①根据上述实验,写出SOCl2和水反应的化学方程式____。
②AlCl3溶液蒸干灼烧得不到无水AlCl3,而用SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3,其原因是____。
(2)25℃时,将amol/L氨水与0.01mol/L盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显__(填“酸”、“碱”或“中”)性。
(3)向含有BaSO4固体的溶液中滴加Na2CO3溶液,当有BaCO3沉淀生成时溶液中![]() __。
__。
[已知Ksp(BaCO3)=2.2×10–9,Ksp(BaSO4)=1.1×10–10]。
(4)次磷酸(H3PO2)是一种精细化工产品。常温下,K(H3PO2)=1×10–2,0.1mol/L的H3PO2溶液在加水稀释过程中,下列表达式的数据一定变小的是_。(填序号)
A.c(H+) B.![]() C.c(H+)·c(OH-) D.
C.c(H+)·c(OH-) D.![]()
【答案】SOCl2+H2O=SO2↑+2HCl↑ SOCl2和H2O生成SO2和HCl,一方面使水的物质的量减少,另一方面,生成HCl抑制AlCl3的水解,所以SOCl2与AlCl3·6H2O混合共热,可得到无水AlCl3 中 20 AB
【解析】
(1)①产生白雾,往溶液中滴加AgNO3溶液,有不溶于HNO3的白色凝乳状沉淀析出,确定该物质为HCl,有刺激性气味的气体可使滴有品红试液的滤纸褪色,确定该物质为二氧化硫;
②盐酸盐蒸干、灼烧问题,考虑盐酸盐水解;
(2)由电荷守恒分析;
(3)构建沉淀转换新平衡分析;
(4)K(H3PO2)=1×10–2,说明次磷酸(H3PO2)是一元弱酸,用H3PO2![]() H++H2PO2-平衡分析。
H++H2PO2-平衡分析。
![]() 是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,由上面的分析可知,该两种气体应该为氯化氢和二氧化硫,反应的方程式为
是一种液态化合物,与水发生剧烈的非氧化还原反应,生成两种有刺激性气味的气体,由上面的分析可知,该两种气体应该为氯化氢和二氧化硫,反应的方程式为![]() ,故答案为:
,故答案为:![]() ;
;
![]() 与水反应生成的氯化氢会对氯化铝水解起到抑制作用,蒸干
与水反应生成的氯化氢会对氯化铝水解起到抑制作用,蒸干![]() 溶液不能得到无水
溶液不能得到无水![]() ,使
,使![]() 与
与![]() 混合并加热,可得到无水
混合并加热,可得到无水![]() ,
,![]() 与水反应生成的氯化氢会对氯化铝水解起到抑制作用,故答案为:
与水反应生成的氯化氢会对氯化铝水解起到抑制作用,故答案为:![]() 和
和![]() 生成
生成![]() 和HCl,一方面使水的物质的量减少,另一方面,生成HCl抑制
和HCl,一方面使水的物质的量减少,另一方面,生成HCl抑制![]() 的水解,所以
的水解,所以![]() 和
和![]() 混合共热,可得到无水
混合共热,可得到无水![]() ;
;
![]() 根据电荷守恒:
根据电荷守恒:![]() ,溶液中
,溶液中![]() ,则有
,则有![]() ,说明溶液为中性,故答案为:中;
,说明溶液为中性,故答案为:中;
(3)BaSO4(s)+CO32-(aq)![]()
![]() ,
,![]() ,所以
,所以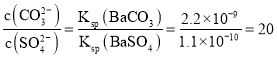 ,故答案为:20;
,故答案为:20;
(4)次磷酸(H3PO2)是一元弱酸,用如下平衡分析H3PO2![]() H++H2PO2-:
H++H2PO2-:
![]() 的
的![]() 溶液加稀释过程中,溶液中氢离子浓度减小,A正确;
溶液加稀释过程中,溶液中氢离子浓度减小,A正确;
B.![]() 的
的![]() 溶液加稀释过程中,
溶液加稀释过程中,![]() 和
和![]() 均减小,同时醋酸的电离向右移动,
均减小,同时醋酸的电离向右移动,![]() 减小的程度小于
减小的程度小于![]() 的减小程度,则
的减小程度,则![]() 减小,B正确;
减小,B正确;
C.![]() 只受温度的影响,温度不变则其值是一个常数,C错误;
只受温度的影响,温度不变则其值是一个常数,C错误;
D.![]() 稀释,酸性减弱,
稀释,酸性减弱,![]() 减小,水的离子积不变,则
减小,水的离子积不变,则![]() 增大,所以
增大,所以![]() 增大,D错误;
增大,D错误;
故答案为:AB。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
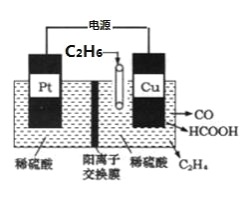
小学生10分钟应用题系列答案【题目】为解决“温室效应”日趋严重的问题,科学家们不断探索CO2的捕获与资源化处理方案,利用CH4捕获CO2并转化为CO和H2混合燃料的研究成果已经“浮出水面”。
已知:①CH4(g)十H2O(g)=CO(g)+3H2(g) △H1=+206.4kJ/mol
②CO(g)+H2O(g)=CO2(g)+H2(g) △H2=-41.2kJ/mol
T1℃时,在2L恒容密闭容器中加入2molCH4和1molCO2,并测得该研究成果实验数据如下:
时间/s | 0 | 10 | 20 | 30 | 40 | 50 | 60 |
CO2/mol | 1 | 0.7 | 0.6 | 0.54 | 0.5 | 0.5 | 0.5 |
H2/mol | 0 | 0.6 | 0.8 | 0.92 | 1 | 1 | 1 |
请回答下列问题:
(1)该研究成果的热化学方程式③CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=__。
(2)30s时CH4的转化率为__,20~40s,v(H2)=__。
(3)T2℃时,该反应的化学平衡常数为1.5,则T2__T1(填“>”“=”或“<”。)
(4)T1℃时反应③达到平衡的标志为__。
A.容器内气体密度不变
B.体系压强恒定
C.CO和H2的体积分数相等且保持不变
D.2v(CO)逆=v(CH4)正
(5)上述反应③达到平衡后,其他条件不变,在70s时再加入2molCH4和1molCO2,此刻平衡的移动方向为__(填“不移动”“正向
(6)由图可知反应在t1、t2、t3时都达到了平衡,而在t2、t4、t8时都改变了条件,试判断t2时改变的条件可能是__。若t4时降低温度,t5时达到平衡,t6时增大了反应物浓度,请补t4~t6时逆反应速率与时间的关系曲线___。