题目内容
下列各组性质的比较中正确的是
| A.酸性:HClO4<H2SO4<H3PO4 | B.碱性:Ba(OH)2>Ca(OH)2>Mg(OH)2 |
| C.稳定性:HF>HCl>PH3>H2S | D.原子半径:O>S>Na |
B
解析试题分析:A、根据元素周期律非金属性:Cl>S>P,所以最高价含氧酸的酸性为HClO4>H2SO4>H3PO4 ,错误;B、 同主族元素从上到下金属性逐渐增强,所以碱性逐渐增强,正确;C、稳定性PH3<H2S,错误;D、根据半径的比较原则,三种元素的原子半径:O<S<Na,错误,答案选B。
考点:考查元素周期律的应用

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
依据元素周期表及元素周期律,下列推断正确的是
| A.同周期主族元素的原子形成的简单离子电子层结构相同 |
| B.C比Si的原子半径小,CH4的稳定性比SiH4弱 |
| C.Na、Mg、Al失电子能力和其最高价氧化物对应的水化物的碱性均依次减弱 |
| D.在元素周期表金属与非金属的分界处可以寻找催化剂和耐高温、耐腐蚀的合金材料 |
已知某粒子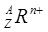 ,则元素R的原子序数是( )。
,则元素R的原子序数是( )。
| A.Z | B.A-Z | C.Z-n | D.Z+n |
元素R、X、T、Z、Q在元素周期表中的相对位置如下表所示, 其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是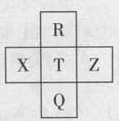
| A.非金属性:Z<T<X |
| B.R与Q的电子数相差26 |
| C.气态氢化物稳定性:R <T<Q |
| D.最高价氧化物的水化物的酸性:T>Q |
现有A、B、C、D四种短周期非金属元素,原子最外层电子数之和为19。在化合物中,这四种元素常见化合价均不止一种,但有一种相同的化合价。其部分性质如下:
| 元素 | A | B | C | D |
| 原子半径/nm | 0.102 | 0.077 | 0.117 | 0.075 |
| 最高正价或最低负价 | +6 | -4 | +4 | -3 |
下列说法错误的是( )
A.四种元素在化合物中具有一种相同的化合价,即+4
B.高温下B可从C的氧化物中置换出C的单质
C.四种元素的最高价含氧酸均为强酸
D.只由非金属元素组成且含D元素的化合物中可能含有离子键
关于原子结构、元素性质的说法正确的是( )
| A.随原子序数的递增,元素原子的核外电子数增多,原子半径逐渐减小 |
| B.若两种不同的核素具有相同的中子数,则二者一定不属于同种元素 |
| C.在化学反应中,原子首先失去的电子能量最低 |
| D.在元素周期表中,各主族元素的最高化合价与其族序数相等 |
已知碳有两种常见的同位素12C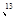 C;氧也有常见的三种同位素16O、17O、18O。由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有( )。
C;氧也有常见的三种同位素16O、17O、18O。由这5种粒子构成的二氧化碳分子中,其相对分子质量最多可能有( )。
| A.6种 | B.10种 | C.11种 | D.12种 |