题目内容
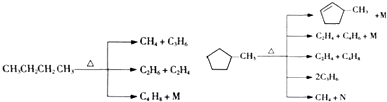
【题目】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) 
A.图1所示的装置能将化学能转变为电能
B.图2所示的反应为吸热反应
C.中和反应中,反应物的总能量比生成物的总能量低
D.化学反应中能量变化的主要原因是化学键的断裂与生成
【答案】D
【解析】解:A.图1没有形成闭合回路,不能构成原电池装置,因此不能将化学能转化为电能,故A错误; B.图2中反应物的总能量大于生成物的总能量,为放热反应,故B错误;
C.中和反应是放热反应,反应物的总能量大于生成物的总能量,故C错误;
D.化学反应时断键要吸收能量,成键要放出能量,所以化学反应中能量变化的主要原因是化学键的断裂与生成,故D正确;
故选D.
A.图1没有形成闭合回路,不能构成原电池装置;
B.反应物的总能量大于生成物的总能量,为放热反应;
C.中和反应是放热反应;
D.化学反应时断键要吸收能量,成键要放出能量.

 优百分课时互动系列答案
优百分课时互动系列答案 开心蛙状元作业系列答案
开心蛙状元作业系列答案【题目】二氧化碳的回收利用是环保领域研究热点.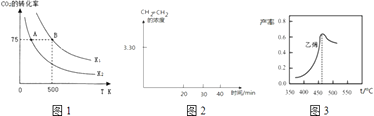
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为 .
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)CH3OH(g)+H2O(l)△H=﹣a kJmol﹣1;
2H2(g)+O2(g)=2H2O(l)△H=﹣b kJmol﹣1;
CH3OH(g)=CH3OH(l)△H=﹣c kJmol﹣1 ,
则CH3OH(l)的标准燃烧热△H= .
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2 , 在一定条件下发生反应,CO2的转化率与温度、投料比X=[ ![]() ]的关系如图2所示.
]的关系如图2所示.
①平衡常数KAKB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低
B.A反应的平衡常数变大
C.生成甲醚的量增加
D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2 . 常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10﹣7 , Ka2=5×10﹣11 , 则0.5molL﹣1的Na2CO3溶液的pH等于(不考虑第二步水解和H2O的电离)