题目内容
【题目】二氧化碳的回收利用是环保领域研究热点.
(1)在太阳能的作用下,以CO2为原料制取炭黑的流程如图1所示.总反应的化学方程式为 .
(2)有一种用CO2生产甲醇燃料的方法:CO2+3H2CH3OH+H2O.已知298K和101KPa条件下:
CO2(g)+3H2(g)CH3OH(g)+H2O(l)△H=﹣a kJmol﹣1;
2H2(g)+O2(g)=2H2O(l)△H=﹣b kJmol﹣1;
CH3OH(g)=CH3OH(l)△H=﹣c kJmol﹣1 ,
则CH3OH(l)的标准燃烧热△H= .
(3)CO2经过催化氢化合成低碳烯烃,合成乙烯反应为2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)△H<0在恒容密闭容器中充入2mol CO2和n mol H2 , 在一定条件下发生反应,CO2的转化率与温度、投料比X=[ ![]() ]的关系如图2所示.
]的关系如图2所示.
①平衡常数KAKB
②T K时,某密闭容器发生上述反应,反应进行到不同时间测得各物质的浓度如表:
时间(min) | 0 | 10 | 20 | 30 | 40 | 50 |
H2(g) | 6.00 | 5.40 | 5.10 | 9.00 | 8.40 | 8.40 |
CO2(g) | 2.00 | 1.80 | 1.70 | 3.00 | 2.80 | 2.80 |
CH2=CH2(g) | 0 | 0.10 | 0.15 | 3.20 | 3.30 | 3.30 |
20~30min间只改变了某一条件,根据上表中的数据判断改变的条件可能是
A.通入一定量H2 B.通入一定量CH2=CH2C.加入合适催化剂D.缩小容器体积
在图2中画出CH2=CH2的浓度随反应时间的变化
(4)在催化剂M的作用下,CO2和H2同时发生下列两个反应
A.2CO2(g)+6H2(g)CH2=CH2(g)+4H2O(g)△H<0
B.2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g)△H<0
图3是乙烯在相同时间内,不同温度下的产率,则高于460℃时乙烯产率降低的原因不可能是
A.催化剂M的活性降低
B.A反应的平衡常数变大
C.生成甲醚的量增加
D.B反应的活化能增大
(5)Na2CO3溶液也通常用来捕获CO2 . 常温下,H2CO3的第一步、第二步电离常数分别约为Ka1=4×10﹣7 , Ka2=5×10﹣11 , 则0.5molL﹣1的Na2CO3溶液的pH等于(不考虑第二步水解和H2O的电离)
【答案】
(1)CO2 ![]() C+O2
C+O2
(2)a+c﹣1.5b kJ?mol﹣1
(3)>;D;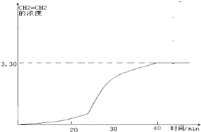
(4)B,D
(5)12
【解析】解:(1)在700K条件下,CO2和FeO发生反应生成C和Fe3O4 , 过程1中Fe3O4分解生成FeO和O2 , 所以整个反应过程中FeO作催化剂,根据反应物和生成物及反应条件书写方程式为CO2 ![]() C+O2 ,
C+O2 ,
所以答案是:CO2 ![]() C+O2;(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=﹣a kJmol﹣1;
C+O2;(2)1mol甲醇完全燃烧生成稳定氧化物放出的热量为甲醇的燃烧热,①CO2(g)+3H2(g)=CH3OH(g)+H2O(l)△H=﹣a kJmol﹣1;
②2H2(g)+O2(g)=2H2O(l)△H=﹣b kJmol﹣1;
③CH3OH(g)=CH3OH(l)△H=﹣c kJmol﹣1 ,
根据盖斯定律,②× ![]() ﹣①﹣③得到CH3OH(l)+
﹣①﹣③得到CH3OH(l)+ ![]() O2(g)═CO2(g)+2H2O(l),所以反应的△H=(﹣
O2(g)═CO2(g)+2H2O(l),所以反应的△H=(﹣ ![]() +a+c)kJ/mol=a+c﹣1.5b kJmol﹣1 , 所以答案是:a+c﹣1.5b kJmol﹣1 (3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小,即平衡常数KA>KB;所以答案是:>;
+a+c)kJ/mol=a+c﹣1.5b kJmol﹣1 , 所以答案是:a+c﹣1.5b kJmol﹣1 (3)①温度越高,二氧化碳的转化率降低,所以反应逆向进行,得到反应是放热的,温度升高,K减小,即平衡常数KA>KB;所以答案是:>;
②20~30min间各组分的浓度都增加,所以可能是缩小容器体积的结果,相当于增大压强,CH2=CH2的浓度随反应时间的变化情况曲线如下: (在20﹣30分钟内曲线突然变陡),所以答案是:D;
(在20﹣30分钟内曲线突然变陡),所以答案是:D; 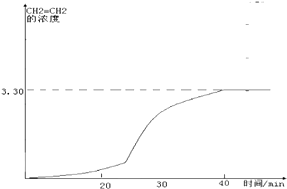 (在20﹣30分钟内曲线突然变陡);(4)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,故选BD;(5)根据Kh=
(在20﹣30分钟内曲线突然变陡);(4)影响产物产率的因素只能是引起平衡移动的因素,反应的活化能增大因素都是和催化剂有关的因素,催化剂只能改变反应速率,不会引起平衡移动,乙烯产率不会影响,反应的平衡常数变大是温度的变化引起的,反应是放热的,平衡常数变大是因为升高温度,不符合题意,故选BD;(5)根据Kh= ![]() =
= ![]() =
= ![]() =2×10﹣4=
=2×10﹣4= ![]() ,所以c(OH﹣)=10﹣2mol/L,pH=12.所以答案是:12.
,所以c(OH﹣)=10﹣2mol/L,pH=12.所以答案是:12.
【考点精析】掌握化学平衡状态本质及特征和弱电解质在水溶液中的电离平衡是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);当弱电解质分子离解成离子的速率等于结合成分子的速率时,弱电解质的电离就处于电离平衡状态;电离平衡是化学平衡的一种,同样具有化学平衡的特征.条件改变时平衡移动的规律符合勒沙特列原理.