��Ŀ����
����Ŀ��Ī����[(NH4)2Fe(SO4)2��6H2O](dz��ɫ)��������ѧ�Լ���ҽҩ�Լ�����ұ�𡢵�Ƶȡ�ij������ͨ��ʵ����̽��Ī���ξ������ʱ�ķֽ����ش��������⣺
��1����ͬѧ������룻�ֽ���������N2��Fe2O3��SO3��H2O�������ʡ����Ƿ�ͬ�Ⲣ˵������___________________________��
��2����ͬѧ�������ͼװ�ã�
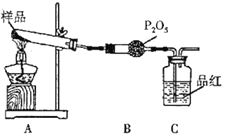
������Aװ���еĹ����Ϊ����ɫ�����������к���_________________��Cװ���к�ɫ��ȥ��˵����������к���_______________________��
��Ϊ��֤A�в������Ƿ���FeO����Ҫѡ���Լ���__________��
A.KSCN��Һ B.Ũ���� C.KMnO4��Һ D.ϡ����
��3����ͬѧ��������ͬѧ��װ��֤���ֽ�����к��а�����ֻ�����B��C �е��Լ����ɣ����������Լ�BΪ______________��CΪ________________��
��4����ͬѧ��ΪĪ���ξ���ֽ����������к���SO3(g)��SO2(g)��N2��Ϊ�˽�����֤����ͬѧѡ����ͬѧ��Aװ�ú���ͼװ����װ�����ʵ�顣
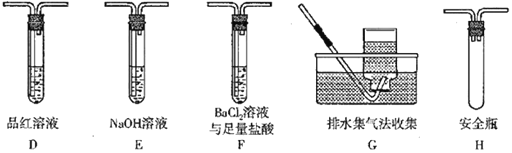
�ٶ�ͬѧ��ʵ���У�װ���������ӵĺ���˳��ΪA��________��
��װ��F�У����������������____________________��
���𰸡� �������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽� Fe2O3 SO2 CD ��ʯ�� ��ɫʯ����Һ HFDEG ������Һ����ȣ�����SO2���ܽ�
����������1����ͬѧ������룻�ֽ���������N2��Fe2O3��SO3��H2O�������ʣ������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽���������������ԭ��Ӧ���ɣ���ȷ�𰸣��������ֲ��������ֻ�л��ϼ۵���û�л��ϼ۽���
��2��������������Ϊ����ɫ�����Թ�������к���Fe2O3��Ʒ����ɫ��˵�������˶����������壻��ȷ�𰸣�Fe2O3 ��SO2 ��
��A�в������ȼ���ϡ���ᣬ����FeO�������������������ټ���KMnO4��Һ���������ӱ�������������ر���ԭ����Һ��ɫ��֤�������������ӣ�ԭ�����к���FeO����ȷѡ��CD ��
��3���Լ�B�м����ʯ�ң����ն����������壬Ȼ�����ð�����ˮ��Һ�Լ��ԣ�ʹ��ɫʯ����Һ������֤���а������ɣ���ȷ�𰸣���ʯ�ң� ��ɫʯ����Һ��
��4���ٿ�֪Aװ�ú����ֱ�����Ӵ�����Һ��װ�ÿ��ܻᷢ�����������Aװ�ú�Ӧ���Ӱ�ȫƿH����![]() ������ˮ����֪Ӧ����
������ˮ����֪Ӧ����![]() ����
����![]() �����������ͨ��Fװ�ã�����
�����������ͨ��Fװ�ã�����![]() Ӧѡ��Ʒ����Һ�� F���D����
Ӧѡ��Ʒ����Һ�� F���D����![]() ���ж����壬D���E�����ն����������壬�������G�������Ƿ���
���ж����壬D���E�����ն����������壬�������G�������Ƿ���![]() ��������ȷ����HFDEG��
��������ȷ����HFDEG��
��װ��F�У����������������������Һ����ȣ�����SO2���ܽ⣻��ȷ�𰸣�������Һ����ȣ�����SO2���ܽ⡣