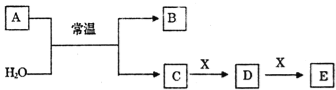
��Ŀ����
����Ŀ������ѧ��ѡ��5���л���ѧ������
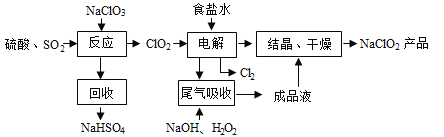
��Ⱦ�����Чȥ������Դ�ij�������ǻ�ѧ�츣�������Ҫ�о����⡣ij�о�С���������̿�(��Ҫ�ɷ�ΪMnO2��������������������ͭ�����Ƚ���������)���������ͨ�����¼����̼��ѳ�ȼúβ���е�SO2�����Ƶõ�ز���MnO2����Ӧ������ʡ�ԣ���

��ش��������⣺
(1)���������ж����Ƶ����˲�����ʵ���ҽ��й��˲���ʱ��Ҫ�õ��Ĺ����������в��������ձ���_______________�����в�������������___________________��
(2)��MnCO3�ܳ�ȥ��Һ�е�Al3+��Fe3+����ԭ����_____________(ֻ�����ֱ���)
(3)��ҵ�ϲ��õ��K2MnO4ˮ��Һ�ķ���������KMnO4�����ж��Ե缫��������������������д�������ĵ缫��Ӧʽ__________________��
(4)���и����Լ��У���ȷ�ⶨһ�����ȼúβ����SO2��������__________��(����)
a��NaOH��Һ����̪��Һ b��ϡH2SO4�ữ��KMnO4��Һ
c����ˮ��������Һ d����ˮ����̪��Һ
(5)������SO2��ϡ�����ữ�����̿�Ӧ�Ļ�ѧ����ʽΪ_______________����֪������SO2Ũ��Ϊ6.4g/m3�����̿�SO2�������ʿɴ�90%������1000m3ȼúβ�����ɵõ������̾���(MnSO4��H2O����Է�������Ϊ169)����Ϊ_________________kg(�������3 λ��Ч����)��
���𰸡���1��©����2�֣� ��������ֹҺ�彦����2�֣�
��2��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������2�֣�
��3��MnO42����e���TMnO4����2�֣� ��4��bc��2�֣�
��5��SO2+MnO2=MnSO4��3�֣� 15.2��2�֣�
��������
�����������1�����˲�����Ҫ�ձ���©�����������������ֲ����������ǹ��������������в���������������������ֹҺ�彦�������á�
��2����������������ˮ������������������������������ӣ�����MnCO3��������Һ�е��ᣬ�ٽ�Al3+��Fe3+ˮ�������������������
��3����������������������Ӧ��Ԫ�صĻ��ϼ����ߣ���MnO42-������ΪMnO4-�����������ĵ缫��ӦʽΪMnO42����e���TMnO4����
��4��a.��������������������Һ��Ӧ�����ɵ��������ƻ����������ƻ���ߵĻ������������ȷ�������Բ��ܼ����������ĺ���������b.�������������Ը��������Һ����������ԭ��Ӧ����Ӧֻ��һ��������̶������Կ���ȷ�����������ĺ�������ȷ��c.������������ۡ���ˮ��Һ����������ԭ��Ӧ������̶������������ԣ�����ȷ�����������ĺ�������ȷ��d.��ˮ��������Һ�����������Ӧ�IJ��������������李���������李����߶��ߵĻ������ﲻ�̶������Բ���ȷ�����������ĺ���������ѡbc��
��5��SO2��ϡ�����ữ�����̿���������ԭ��Ӧ���������̣���Ӧ����ʽΪSO2+MnO2=MnSO4������ԭ���غ㣬�����յ�SO2 �����ʵ������������̾�������ʵ������������̾��������Ϊ��1000m3��6.4 g/m3��90%����64g/mol��169g/mol=15.2 kg��

����Ŀ��Ϊ��ȥ�����е�Ca2����Mg2����Fe3����SO42���Լ���ɳ�����ʣ�ijͬѧ�����һ���Ʊ����ε�ʵ�鷽�����������£����ڳ������Լ��Թ�������
![]()
![]()
��1���ж�BaCl2�ѹ����ķ����� ��
��2���������У���صĻ�ѧ����ʽ�� ��
��3������NaCl��Һʱ�����������в���������ƫ����ƫ�ͣ�
A������ʱNaCl�ѳ��⣨ �� |
B����ƽ����������ʴ�� �� |
C������ҡ��ʱ��Һ���½��ּ�ˮ�� �� |
D������ʱ���ӿ̶��ߣ� �� |