题目内容
现甲、乙两化学小组安装两套如下相同装置,用以探究影响H2O2分解速率的因素。

(1)仪器a的名称______;检查装置气密性的操作为______。
(2)MnO2催化下H2O2分解的化学方程式是______。
(3)甲小组有如下实验设计方案,请帮助完成(所有空均需填满)。

⑷甲、乙两小组得出如图数据。
①由甲组实验II得出的数据可知:浓度越大,H2O2分解速率______;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是______;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为______;支持这一方案的理由是____________。


(1)仪器a的名称______;检查装置气密性的操作为______。
(2)MnO2催化下H2O2分解的化学方程式是______。
(3)甲小组有如下实验设计方案,请帮助完成(所有空均需填满)。

⑷甲、乙两小组得出如图数据。
①由甲组实验II得出的数据可知:浓度越大,H2O2分解速率______;
②由乙组研究的酸、碱对H2O2分解影响因素的 数据分析:相同条件下,Na2O2和K2O2溶于水放出气体速率较快的是______;乙组提出可以用BaO2固体与H2SO4溶液反应制H2O2,其化学反应方程式为______;支持这一方案的理由是____________。

(14分)(1)锥形瓶(1分)将注射器活塞固定,向分液漏斗中注入适量蒸馏水,打开分液漏斗活塞,如果分流漏斗颈部能形成稳定的水柱,说明装置气密性良好,反之则气密性差。(或关闭分液漏斗活塞,加热锥形瓶,如果注射器活塞外移,停止加热后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。或关闭分液漏斗活塞,用力将注射器活塞外移,停止用力后注射器活塞回到原来位置,则说明气密性良好,反之则气密性差。)(2分其他合理答案也给分)(2)2H2O2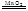 2H2O+O2↑(2分)(3)
2H2O+O2↑(2分)(3)
(各1分,共2分)(4)①越快(1分)②K2O2(2分)BaO2+H2SO4=BaSO4↓+H2O2(2分)制备H2O2的环境为酸性环境,H2O2分解速率较慢(2分)
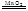 2H2O+O2↑(2分)(3)
2H2O+O2↑(2分)(3)| | 探究浓度对速率的影响 | | 3滴FeCl3溶液 | |
(各1分,共2分)(4)①越快(1分)②K2O2(2分)BaO2+H2SO4=BaSO4↓+H2O2(2分)制备H2O2的环境为酸性环境,H2O2分解速率较慢(2分)
试题分析:(1)检查装置气密性可用加水法或加热法或抽气法。
(3)实验I和IIH2O2浓度不同,实验目的是探究浓度对速率的影响,所以II也只能加3滴氯化铁溶液。
(4)①由图像可看出甲组实验II斜率大,完全放出氧气所用时间少,反应速率快,所以过氧化氢浓度越大,反应速率越快。②碱性条件下过氧化氢分解速率比酸性条件下过氧化氢分解速率快,过氧化钾溶于水生成的KOH比过氧化钠溶于水生成的氢氧化钠碱性强,过氧化钠和过氧化钾溶于水放出氧气速率较快的是过氧化钾;过氧化钡与硫酸生成硫酸钡和过氧化氢,酸性条件下过氧化氢分解速率较慢,可以用该反应制备过氧化氢。

练习册系列答案
 53天天练系列答案
53天天练系列答案
相关题目

 的浓度。影响反应速率的因素是
的浓度。影响反应速率的因素是 

