题目内容
(10分)工业上综合利用黄铜矿(CuFeS2)制备净水剂高铁酸钠(Na2FeO4)、铜及其化合物的工业流程如下图所示:
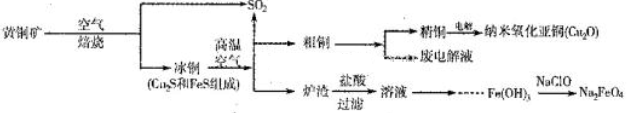
(1)冶炼铜的反应为8CuFeS2+21O2 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
当吸收液呈中性时,溶液中离子浓度由大到小的顺序为是________________。

(1)冶炼铜的反应为8CuFeS2+21O2
 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。(2)利用炉渣(含Fe2O3、FeO、SiO2、Al2O3)制备高铁酸钠的方法为:
①用稀盐酸浸取炉渣,过滤;
②向滤液中加入足量H2O2溶液,再加入足量NaOH溶液,过滤,将沉淀洗涤、于燥得Fe(0H)3;
③Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。
a.写出制取高铁酸钠的化学方程式:______________________;
b.验证炉渣中含有FeO必要的化学试剂为________________________。
(3)制备纳米氧化亚铜(Cu2O)时用铜棒和石墨做电极,饱和食盐水做电解质,电解反应为2Cu+H2O
 Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 1:91 |
| pH(25℃) | 8.2 | 7.2 | 6.2 |
(1)12.5mol(2分)
(2)2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O(2分) 稀硫酸 KMnO4(2分)
(3)2Cu-2e-+H2O=Cu2O+2H+(2分)
(4)c(Na+)>c(HSO3-)>c(SO32-) >c(OH-)=c(H+) (2分)
(2)2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O(2分) 稀硫酸 KMnO4(2分)
(3)2Cu-2e-+H2O=Cu2O+2H+(2分)
(4)c(Na+)>c(HSO3-)>c(SO32-) >c(OH-)=c(H+) (2分)
试题分析:(1)CuFeS2铁元素的化合价为+2,则S元素的化合价为-2价。在反应中铁元素的化合价部分从+2价升高到+3价,失去1个电子。S元素的化合价从-2价升高到+4价,失去6个电子。铜元素的化合价从+2价降低到0价,氧元素的化合价从0价降低到-2价。因此8molCuFeS2处于反应共转移电子的物质的量=8mol×2+21mol×4=100mol,则1molCuFeS2参与反应转移电子的物质的量为
 =12.5mol。
=12.5mol。(2)a、Fe(OH)3与NaClO和NaOH反应,生成高铁酸钠。在反应中铁元素的化合价从+3价升高到+6价,失去3个电子。氯元素的化合价从+1价降低到-1价,得到2个电子。因此根据电子得失守恒可知,还原剂Fe(OH)3与氧化剂NaClO的物质的量之比=2:3,则反应的化学方程式为2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3NaCl+5H2O。
b、FeO中铁元素的化合价为+2价,具有还原性。因此要验证炉渣中含有FeO,则可以用硫酸酸酸化的高锰酸钾溶液,实验现象是溶液褪色,因此需要的试剂是稀硫酸、高锰酸钾。
(3)根据总的方程式可知,在反应中铜元素的化合价升高,因此铜与电源的正极相连,作阳极,失去电子发生氧化反应,电极反应式为2Cu-2e-+H2O=Cu2O+2H+。
(4)根据表中数据可知,随着n(SO32-):n(HSO3-)的减小,溶液的酸性逐渐增强。所以当溶液显中性时n(SO32-):n(HSO3-)<1:1,则溶液中离子浓度大小顺序是c(Na+)>c(HSO3-)>c(SO32-) >c(OH-)=c(H+)。

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案
相关题目