题目内容
我国从澳大利亚进口的某高炉生铁(用A表示)的成分如下(其余是铁):
(1)称取100.000g A经过一系列处理(最后一步是在空气中灼烧)后,锰全部转变为某种氧化物,其质量为0.687g,则其化学式为 。
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数至少是 %。
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢 吨。
(4)某炼钢厂的烟尘成分和质量分数如下表:
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,若铁的氧化物中只有两种物质组成,则铁的氧化物的组成和物质的量之比如何?
| C | Si | Mn | P | S |
| 4.070% | 2.900% | 0.495% | 0.165% | 0.010% |
(2)磷肥的肥效以相当含P2O5多少来表示。炼钢时,P元素形成炉渣Ca3(PO4)2,后者再与浓硫酸反应制得普通过磷酸钙[即普钙,成分是CaSO4、Ca(H2PO4)2和少量其它杂质]。若某普钙中Ca(H2PO4)2的质量分数为45.25%,则含P2O5的质量分数至少是 %。
(3)锰的质量分数为30%的高锰钢有很好的性能,可制作火车车轮。将A冶炼成含碳0.4%、含锰30%的高锰钢(设铁无损耗,其它杂质已除去,可补充锰),则100吨A可制得高锰钢 吨。
(4)某炼钢厂的烟尘成分和质量分数如下表:
| | FeO | Fe2O3 | CaO |
| 烟尘煅烧前(%) | 86.40 | 4.00 | 9.60 |
为了减少烟尘的排放,将烟尘与CO混合后在空气中煅烧,得到铁的氧化物和CaO的烧结物,其中CaO的质量分数为8.92%(金属元素无损耗),烧结物分离出CaO后,若铁的氧化物中只有两种物质组成,则铁的氧化物的组成和物质的量之比如何?
(1)Mn3O4(2分)
(2) 27.46
(3)132.701(3分)
(4)反应后固体混合物中 n(Fe):n(O)=1:1.4
①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;
②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;
(2) 27.46
(3)132.701(3分)
(4)反应后固体混合物中 n(Fe):n(O)=1:1.4
①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;
②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;
试题分析:(1)100.000g A含有Mn的质量=100.000g×0.495%=0.495g,所得MnxOY中O元素的质量=0.687g-0.495g=0.192g,则:x:y="0.495/55" :0.192/16=3:4,故该氧化物的化学式为Mn3O4,故答案为:Mn3O4;
(2)将Ca(H2PO4)2改写CaH4O3?P2O5,含P2O5的质量分数═45.25%×142/234=27.46%,普钙中还可能还有Ca3(PO4)2,所以用P2O5表示的质量分数还可能大于27.46%,故P2O5的质量分数≥27.46%,故答案为:≥27.46%;
(3)令可以生成高锰钢y吨,根据Fe元素质量不变,则:y×(1-30%-0.4%)=100×(1-4.070%-2.9%-0.495%-0.165%-0.010%)解得:y=132.701,故答案为:132.701;
(4)假设烟尘煅烧前烟尘的质量为100g,则n(FeO)=1.2mol,n(Fe2O3)=0.025mol,Fe元素物质的量=1.2mol+0.05mol=1.25mol,其质量=1.25mol×56g/mol=70g,烟尘煅烧前后Fe元素的质量不变.煅烧后CaO的质量也不变,煅烧后物质的质量=100*9.6%/8.92%=107.6g,其中O元素的质量=107.6g×(1-8.92%)-70g=28.0g,n(O)=28/16=1.75mol,反应后固体混合物中 n(Fe):n(O)=1.25mol:1.75mol=1:1.4,故烟尘煅烧后铁的氧化物的平均组成为FeO1.4。铁的常见氧化物有FeO、Fe2O3、Fe3O4,①若是FeO和Fe2O3的混合物,令FeO和Fe2O3的分别为xmol、ymol,则(X+3Y)/(X+2Y)=1.4,整理得x:y=1:2,故FeO和Fe2O3的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,令Fe3O4和Fe2O3的xmol、ymol,则(4X+3Y)/(3X+2Y)=1.4,整理得x:y=1:1,故Fe3O4和Fe2O3的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不符合平均组成,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,利用极限法判断,若FeO和Fe2O3的混合物,Fe2O3的含量最高为2/3=66.7%,若为Fe3O4和Fe2O3的混合物,Fe2O3的含量最低为1/2=50%,故50%<Fe2O3的物质的量分数<66.7%,答:①若是FeO和Fe2O3的混合物,则它们的物质的量之比为1:2;②若是Fe3O4和Fe2O3的混合物,则它们的物质的量之比为1:1;③若是FeO和Fe3O4的混合物,不合理;④若是FeO、Fe2O3和Fe3O4的混合物,50%<Fe2O3的物质的量分数<66.7%。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
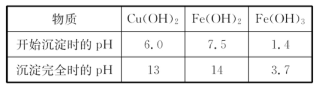


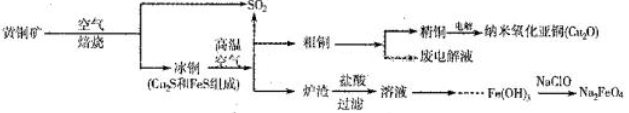
 8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。
8Cu+4FeO+2Fe2O3+16SO2。若中CuFeS2铁元素的化合价为+2,1molCuFeS2参与反应转移电子的物质的量为_______ mol。 Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
Cu2O+H2↑。铜棒上发生的电极反应式为_________________________________________。(5)直接排放含SO2的烟气会形成酸雨,危害环境。用NaOH溶液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表: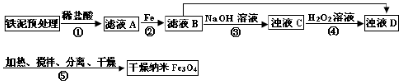
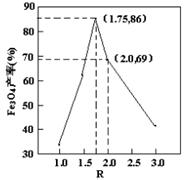
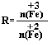 ,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。
,步骤⑤中,相同条件下测得Fe3O4的产率与R的关系如图所示。