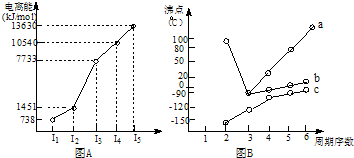
题目内容
、①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向① ;①③相连时,③为正极,②④相连时,②有气泡逸出 ;③ ④ 相连时,③ 的质量减少 ,据此判断这四种金属活动性由大到小的顺序是
A ①③②④ B ①③④② C ③ ④ ②① D ③ ① ②④
【答案】B
【解析】由题意知:①②③④ 四种金属片两两相连浸入稀硫酸中都可组成原电池 ,①②相连时,外电路电流从②流向①,则① 大于②;①③相连时,③为正极,则① 大于③;②④相连时,②有气泡逸出 ,则④大于②;③ ④ 相连时,③ 的质量减少,则③大于 ④,答案:①③④②。
【考点】原电池的正负极的判断(从原电池反应实质角度确定):
(1)由两极的相对活泼性确定:相对活泼性较强的金属为负极,一般地,负极材料与电解质溶液要能发生反应。
(2)由电极变化情况确定:某一电极若不断溶解或质量不断减少,该电极发生氧化反应,则此电极为负极;若某一电极上有气体产生、电极的质量不断增加或不变,该电极发生还原反应,则此电极为正极,燃料电池除外。
【点评】本题考查新型原电池,原电池的两电极反应式,电子流向与电流流向,和金属活动性的判断问题。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
有a、b、c、d四种金属,将a与b用导线连结起来浸入盐酸中,b不易腐蚀;将a、d分别投入等浓度的盐酸中,d比a反应剧烈;将Cu浸入b的盐溶液里,无明显变化;如果把Cu浸入c的盐溶液里,有c的单质析出.据此判断它们的活动性由强到弱的顺序是( )
| A、d、b、a、c | B、b、a、d、c | C、d、a、b、c | D、d、c、a、b |
现有A、B、C、D四种金属,把A、B分别浸入稀硫酸中时,产生气泡都很慢,而将C、D分别浸入稀硫酸中时,反应却很剧烈;把A、B用导线连接浸入稀硫酸中时,A上有气泡产生;把C浸入D的硝酸盐溶液中时,C的表面却有D 析出.则这四种金属的活泼性由强到弱的顺序为( )
| A、A>B>C>D | B、C>D>B>A | C、B>A>D>C | D、D>C>B>A |
分别用X、Y、Z、W四种金属进行如下三个实验:
根据以上事实的下列判断错误的是( )
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y不易腐蚀 |
| 2 | 将X、W分别投入等浓度的稀盐酸中都有气体产生,但W比X反应剧烈 |
| 3 | 用惰性电极电解含等物质的量浓度的Y2+和Z2+混合溶液,在阴极上首先析出单质Z |
| A、Z2+的氧化性可能最强 |
| B、W的金属活动性强于Y |
| C、Z放入CuSO4溶液中一定有Cu析出 |
| D、用X、Z和稀硫酸构成的原电池,X做负极 |