题目内容
(2008?肇庆二模)(1)I.短周期某主族元素M的电离能情况如图(A)所示.则M元素位于周期表的第
II.图B折线c可以表达出第
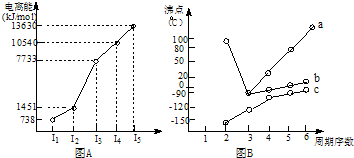
两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:
由这些数据你能得出的结论是(至少写2条):
(2)COCl2俗称光气,分子中C原子采取
a.2个σ键 b.2个π键 c.1个σ键、1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为
II.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的
.则绿色晶体配合物的化学式为
ⅡA
ⅡA
族.II.图B折线c可以表达出第
IVA
IVA
族元素氢化物的沸点的变化规律.
两位同学对某主族元素氢化物的沸点的变化趋势画出了两条折线a和b,你认为正确的是:
b
b
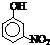
(填“a”或“b”);部分有机物的熔沸点见下表:| 烃 | CH4 | CH3CH3 | CH3(CH2)2CH3 | 硝基苯酚 | 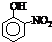 |
 |
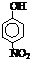 |
| 沸点/℃ | -164 | -88.6 | -0.5 | 熔点/℃ | 45 | 96 | 114 |
有机物分子量越大.分子间作用力越强,故沸点越高
有机物分子量越大.分子间作用力越强,故沸点越高
,当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高
当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高
.(2)COCl2俗称光气,分子中C原子采取
sp2
sp2
杂化成键;其中碳氧原子之间共价键含有c
c
(填字母):a.2个σ键 b.2个π键 c.1个σ键、1个π键.
(3)金属是钛(22Ti) 将是继铜.铁.铝之后人类广泛使用的第四种金属,试回答:
I.Ti元素的基态原子的价电子层排布式为
3d24S2
3d24S2
;II.已知Ti3+可形成配位数为6的配合物.现有紫色和绿色两种含钛晶体,其组成均为TiCl3?6H2O.为测定这两种晶体的化学式,设计了如下实验:
a.分别取等质量的两种晶体的样品配成溶液;b.向两种溶液中分别滴入AgNO3溶液,均产生白色沉淀;c.沉淀完全后分别过滤得两份沉淀,经洗涤干燥后称量发现:其沉淀质量:绿色晶体为紫色晶体的
| 2 |
| 3 |
[TiCl(H2O)5]Cl2?H2O
[TiCl(H2O)5]Cl2?H2O
.分析:(1)I、原子的电离能越大,表示越难失去电子,故化合价也较低,一般来说,元素的电离能按照第一、第二…的顺序逐渐增加,如果突然增加的比较多,电离的难度增大,这里就是元素的通常的化合价;
II.根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断;
(2)准确判断出中心原子的价层电子对,运用互斥模型判断构型;根据杂化轨道理论知识来回答;
(3)I.根据钛元素在周期表中的原子序数以及其原子结构来确定位置、基态原子的电子排布式;
II.在配合物中的氯原子是不能自由移动的,但配离子中可以形成氯离子,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中.
II.根据相对分子质量与物质熔沸点的关系以及氢键的存在对物质性质的影响判断;
(2)准确判断出中心原子的价层电子对,运用互斥模型判断构型;根据杂化轨道理论知识来回答;
(3)I.根据钛元素在周期表中的原子序数以及其原子结构来确定位置、基态原子的电子排布式;
II.在配合物中的氯原子是不能自由移动的,但配离子中可以形成氯离子,氯离子可以与银离子反应生成氯化银白色沉淀,根据沉淀情况可以得到有几个离子在配合物中.
解答:解:(1)I.短周期某主族元素M的第一、第三、第四电离能之间变化不大,第二电离能剧增,且第一电离能很低,则说明该元素原子很难失去第二个电子,最高化合价为+2,应为第IIA族元素,故答案为:ⅡA;
II、在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;
a点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水,故选b;
根据表格知,有机物分子量越大.分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高,
故答案为:IVA;b; 有机物分子量越大.分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;
(2)COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,共有3对价层电子对,需要3个杂化轨道,采取sp2;光气的空间结构是“V”形,其中碳和氧原子之间以共价双键结合,即含有一个π键一个σ键,碳原子再用sp2杂化成键,故答案为:sp2;c;
(3)I.钛元素在周期表中的原子序数为22,位于第四周期第IVB族,基态原子的电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),22Ti元素基态原子的价电子层排布式为3d24s2,故答案为:3d24s2;
II.氯离子可以与银离子反应生成氯化银白色沉淀,通过沉淀的质量可以推断出氯离子的含量,原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
两种晶体的组成皆为TiCl3?6H2O,说明紫色晶体中有三个自由移动的氯离子,而绿色晶体中只有2个自由移动的离子,即有一个氯原子形成了配合物,因为钛为6配位,即配合物中须有五个水,即化学式为[TiCl(H2O)5]Cl2?H2O,而紫色晶体的化学式为[Ti(H2O)6]Cl3,故答案为:[TiCl(H2O)5]Cl2?H2O.
II、在ⅣA~ⅦA中的氢化物里,由于N、O、F电负性大,NH3、H2O、HF因在分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,故沸点高于同主族其它元素氢化物的沸点,只有ⅣA族元素氢化物不存在反常现象;
a点所示的氢化物是水,其沸点高是由于在水分子间存在多条结合力较大的氢键,总强度远远大于分子间作用力,所以氧族元素中其它氢化物的沸点不会高于水,故选b;
根据表格知,有机物分子量越大.分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高,
故答案为:IVA;b; 有机物分子量越大.分子间作用力越强,故沸点越高;当有机能形成分子内氢键时,分子间作用力减弱,熔点变低;当分子间能形成氢键时,分子间作用力增强,熔点升高;
(2)COCl2分子中C原子与Cl原子以单键相结合,与O原子以双键相结合,共有3对价层电子对,需要3个杂化轨道,采取sp2;光气的空间结构是“V”形,其中碳和氧原子之间以共价双键结合,即含有一个π键一个σ键,碳原子再用sp2杂化成键,故答案为:sp2;c;
(3)I.钛元素在周期表中的原子序数为22,位于第四周期第IVB族,基态原子的电子排布式为1s22s22p63S23p63d24s2(或[Ar]3d24s2),22Ti元素基态原子的价电子层排布式为3d24s2,故答案为:3d24s2;
II.氯离子可以与银离子反应生成氯化银白色沉淀,通过沉淀的质量可以推断出氯离子的含量,原绿色晶体的水溶液与AgNO3溶液反应得到的白色沉淀质量为紫色晶体的水溶液反应得到沉淀质量的
| 2 |
| 3 |
点评:本题对物质结构与性质进行综合性考查,难度中等,侧重考查学生运用所学知识对图表、图象分析.特别注意:元素的第一电离能,同周期从左到右有增大趋势,但要注意第ⅡA族和第ⅢA族的反常,如Be>B,Mg>Al;第ⅤA族和第ⅥA族的反常,如N>O,P>S.同主族从上到下逐渐减小.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 和
和 ;“双烯合成反应”又称为“Diels-Alder反应”,如:
;“双烯合成反应”又称为“Diels-Alder反应”,如: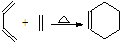 .
. ,则物质A的结构式为:
,则物质A的结构式为: 或CH2=CH-COOH
或CH2=CH-COOH
 中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:
中,D物质可发生反应生成一种生活中常用高分子,其化学方程式为:

 和
和 都是无色液体,下列物质中可以用来鉴别这两种物质的是
都是无色液体,下列物质中可以用来鉴别这两种物质的是