题目内容
【题目】硫化钠是重要的化工原料,多釆用无水芒硝(Na2SO4)—炭粉还原法制备,原理为:Na2SO4+2C![]() Na2S+2CO2↑。其主要流程如图如下:
Na2S+2CO2↑。其主要流程如图如下:
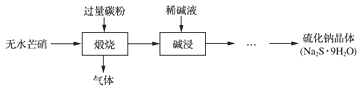
(1)上述流程中采用稀碱液比用热水更好,理由是_____________________。
(2)已知I2+2S2O32-═2I-+S4O62-所制Na2S·9H2O晶体中含有Na2SO4·5H2O等杂质为测定产品成分进行下列实验步骤如下:
a.取试样10.00g配成500.00mL溶液
b.取所配溶液25.00mL于碘量瓶中加入过量ZnCO3悬浊液除去Na2S后过滤向滤液中滴入2~3滴淀粉溶液用0.050 00mol·L-1I2溶液滴定至终点用去5.00mL I2溶液
c.再取所配溶液25.00mL于碘量瓶中加入50.00mL 0.050 00mol·L-1I2溶液并滴入2~3滴淀粉溶液振荡用标准Na2SO4溶液滴定多余I2用去15.00mL 0.100 0mol·L-1 Na2SO4溶液
①步骤b中用ZnCO3除去Na2S离子方程式为_________________。
②判断步骤c中滴定终点方法为________________________。
③计算试样中Na2S·9H2O和Na2SO4·5H2O质量分数(写出计算过程)_________________。
【答案】热水会促进Na2S水解,而稀碱液能抑制Na2S水解; ZnCO3+S2-═ZnS+CO32- 溶液由蓝色变为无色,且半分钟内不变色 试样中Na2S9H2O的质量分数为72%,Na2S2O35H2O的质量分数为24.8%。
【解析】
(1)依据硫化钠溶液中硫离子水解显碱性的水解平衡影响因素分析判断;
(2)①ZnCO3与Na2S反应生成硫化锌和碳酸钠;
②滴定终点为溶液由蓝色变为无色,且半分钟内不变色;
③根据I2~2Na2S2O35H2O可得n(Na2S2O35H2O)=2n(I2),步骤b与c中样品用来相同,则可得到步骤c中Na2S2O3消耗的碘,再根据多余的碘结合I2~Na2S9H2O可知Na2S的物质的量,再由质量分数= ![]() ×100%计算可得。
×100%计算可得。
(1)上述流程中采用稀碱液比用热水更好,硫化钠溶液中硫离子水解显碱性,水解过程是吸热反应,加热促进水解进行,稀碱溶液能起到抑制水解的作用。所以答案为:热水会促进Na2S水解,而稀碱液能抑制Na2S水解;
(2)①ZnCO3除去Na2S的离子方程式为:ZnCO3+S2-═ZnS+CO32-;
②I2遇淀粉溶液会变为蓝色,当I2不断被Na2S2O3消耗,溶液的蓝色会逐渐变浅,当I2被恰好消耗完全时,溶液的颜色由蓝色变为无色,所以滴定终点现象为:溶液由蓝色变为无色,且半分钟内不变色;
③步骤b中消耗的I2有:
n(I2)=0.050 00 mol/L×5.00 mL×10-3 L/mL=2.500×10-4 mol,
n(Na2S2O35H2O)=2n(I2)=5.000×10-4 mol
w(Na2S2O35H2O)=[(5×104mol×248g/mol)÷0.5g]×100%=24.8%;
步骤c中,加入的I2有:
n(I2)=0.05000mol/L×50.00mL×10-3L/mL=2.500×10-4mol由步骤b可知25mL溶液中Na2S2O3消耗的I2有:2.500×10-4 mol,滴入的标准Na2S2O3溶液消耗多余的I2有:15.00 mL×10-3 L/mL×0.100 0 mol/L=7.500×10-4 mol。溶液中Na2S有:
n(Na2S2O39H2O)=n(Na2S)=(2.500×10-3-2.500×10-4-7.500×10-4)mol=1.500×10-3 mol,w(Na2S9H2O)=![]() ×100%=72.0%。
×100%=72.0%。

【题目】下表是元素周期表的一部分,除标出的元素外,表中的每个编号代表一种元素。请根据要求回答问题:
| ⅠA | 0 | |||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | ||
2 | ② | ③ | Ne | ||||||
3 | Na | ④ | ⑤ | ⑥ | |||||
(1)④的原子序数是________;
(2)⑤的原子结构示意图是____________;
(3)②和③两种元素的非金属性强弱关系是:②______③(填“>”、“<”或“=”);
(4)①和⑥两种元素组成的化合物中含有的化学键是____(填“共价”或“离子”)键。