题目内容
1.在下列溶液中Cl-的物质的量浓度最大的是( )| A. | 0.5L 0.1mol/L的NaCl溶液 | B. | 100mL 0.2mol/L的MgCl2溶液 | ||
| C. | 1L 0.2mol/L的AlCl3溶液 | D. | 1L 0.3mol/L盐酸溶液 |
分析 利用物质的构成及溶质的物质的量浓度来计算氯离子的浓度,与溶液的体积无关,以此来解答.
解答 解:A.0.5L0.1mol/L的NaCl溶液中Cl-离子的物质的量浓度为0.1mol/L;
B.100mL0.2mol/L的MgCl2溶液中Cl-离子的物质的量浓度为0.2mol/L×2=0.4mol/L;
C.1L0.2mol/L的AlCl3溶液中Cl-离子的物质的量浓度为0.2mol/L×3=0.6mol/L;
D.1L0.3mol/L盐酸溶液中Cl-离子的物质的量浓度为0.3mol/L,
显然C中Cl-离子的物质的量浓度最大,故选C.
点评 本题考查物质的量浓度的有关计算,明确离子浓度与溶质的物质的量浓度的关系即可解答,较简单.

练习册系列答案
 金钥匙试卷系列答案
金钥匙试卷系列答案
相关题目
11.已知下列三个数据:7.1×10-4 mol•L-1、6.8×10-4 mol•L-1、6.2×10-10 mol•L-1分别是三种酸的电离平衡常数.若这三种酸可发生如下反应:
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是( )
①NaCN+HNO2=HCN+NaNO2 ②NaCN+HF=HCN+NaF ③NaNO2+HF=HNO2+NaF
则下列叙述中不正确的是( )
| A. | HF的电离平衡常数为7.1×10-4 mol•L-1 | |
| B. | HNO2的电离平衡常数为6.2×10-10 mol•L-1 | |
| C. | 根据①③两个反应即可知三种酸的相对强弱 | |
| D. | HNO2的电离平衡常数比HCN的大,比HF的小 |
12.下列说法正确的是( )
| A. | NaCl溶液在电流作用下电离出Na+和Cl- | |
| B. | NaCl是电解质,故NaCl晶体能导电 | |
| C. | 液态氯化氢不能导电,但氯化氢是电解质 | |
| D. | 电解质溶液中自由移动离子的数目越多,该溶液的导电性越强 |
9.下列化学用语与含义不相符的是( )
| A. | Ca2+-钙离子 | B. | AlCl3-氯化铝 | C. | 2H2O-2个水分子 | D. | 2O-2个氧元素 |
6.下列说法中正确的是( )
| A. | O2的摩尔质量是16g | |
| B. | 金属氧化物一定是碱性氧化物,非金属氧化物一定是酸性氧化物 | |
| C. | 同温、同压下,1mol任何气体所含的气体分子数目都相等 | |
| D. | 标准状况下,体积是22.4升的物质,其物质的量一点是1摩尔 |
13.下列除去杂质的方法中正确的是( )
| A. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 溴苯中混有溴,加入NaOH溶液后,用分液漏斗分液 |
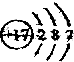 表示Cl(填写元素符号);
表示Cl(填写元素符号); ”表示一个氮原子,则“
”表示一个氮原子,则“ ”表示N2(填写粒子符号)
”表示N2(填写粒子符号)