题目内容
6.将4molSO2和2molO2充入2L的密闭容器中,在一定条件下发生反应,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1,请回答下列问题:(1)用O2表示的反应的平均速率为0.03mol/(L•s);
(2)平衡时SO2的转化率30%;
(3)平衡时SO3的体积分数为22.2%;
(4)10s时O2的浓度为0.7mol•L-1.
分析 在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1;
设转化的氧气的物质的量浓度为x,则
2SO2 +O2 ?2SO3
开始(mol•L-1) 2 1 0
转化(mol•L-1) 2x x 2x
平衡(mol•L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol•L-1;
所以2x=0.6mol•L-1,解得x=0.3mol•L-1,
(1)利用10s内氧气的浓度变化计算反应速率;
(2)利用转化的二氧化硫与起始的二氧化硫计算转化率;
(3)利用平衡时的浓度计算平衡时SO3的体积分数;
(4)根据上面分析求出平衡时氧气的浓度.
解答 解:在一定温度下,将4mol SO2与2molO2放入2L的密闭容器中,c(SO2)=2mol/L,c(O2)=1mol/L,经10s后达到平衡,测得SO3的浓度为0.6mol•L-1;
设转化的氧气的物质的量浓度为x,则
2SO2 +O2 ?2SO3
开始(mol•L-1) 2 1 0
转化(mol•L-1) 2x x 2x
平衡(mol•L-1) 2-2x 1-x 2x
平衡时测得SO3的浓度为0.6mol•L-1;
所以2x=0.6mol•L-1,解得x=0.3mol•L-1,
(1)10s内氧气的浓度变化为△c(O2)=0.3mol•L-1,所以v(O2)=$\frac{△c}{△t}$=$\frac{0.3mol/L}{10s}$=0.03mol/(L•s),
故答案为:0.03mol/(L•s);
(2)平衡时SO2的转化率为:$\frac{消耗量}{起始量}$×100%=$\frac{0.6mol/L}{2mol/L}$×100%=30%,
故答案为:30%;
(3)平衡时的容器内的总浓度为:2-2x+1-x+2x=2.7mol•L-1,所以平衡时SO3的体积分数$\frac{0.6mol/L}{2.7mol/L}$×100%=22.2%,
故答案为:22.2%;
(4)平衡时氧气的浓度:1-x=0.7mol•L-1,
故答案为:0.7mol•L-1.
点评 本题考查化学平衡的计算,化学平衡图象,明确化学平衡的三段法计算格式及计算方法是解答本题的关键,注意利用平衡浓度、转化率概念计算,题目难度中等.

| A. | 0.5L 0.1mol/L的NaCl溶液 | B. | 100mL 0.2mol/L的MgCl2溶液 | ||
| C. | 1L 0.2mol/L的AlCl3溶液 | D. | 1L 0.3mol/L盐酸溶液 |
 某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气 | |
| D. | 根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收 |
| A. | 塑化剂属于脂类,多数水果中都含有脂类,因此次白酒可放心使用 | |
| B. | 塑化剂易溶于酒精,因此不宜用塑料桶盛装酒类 | |
| C. | DEHP、DIBP、DBP属于同系物 | |
| D. | DBP的结构简式为 |
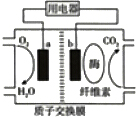 最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )| A. | 该电池属于燃料电池 | |
| B. | 该电池可在高温下使用 | |
| C. | a为该电池的负极 | |
| D. | b极附近的电极反应为:(C6H10O5)π+7nH2O+24ne-=6nCO2+24nH+ |
| A. | 明矾可用作净水剂 | B. | 食醋可用于清除暖水瓶中的水垢 | ||
| C. | 氢氧化钠可用来治疗胃酸过多 | D. | 过氧化钠可用作潜艇里氧气来源 |
 ③
③

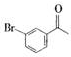 ;B
;B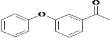 .
. 的其他同分异构体(必须含有苯环和羰基):
的其他同分异构体(必须含有苯环和羰基):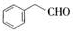 、
、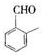 、
、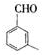 、
、 .
.