题目内容
13.下列除去杂质的方法中正确的是( )| A. | 苯甲醛中混有苯甲酸,加入生石灰,再加热蒸馏 | |
| B. | 乙醇中混有乙酸,加入NaOH溶液后,用分液漏斗分液 | |
| C. | 乙烷中混有乙烯,加入氢气在一定条件下充分反应 | |
| D. | 溴苯中混有溴,加入NaOH溶液后,用分液漏斗分液 |
分析 A.苯甲酸与CaO反应后,增大与苯甲醛的沸点差异;
B.乙酸与NaOH溶液反应后,与乙醇互溶;
C.乙烷中易引入新杂质氢气;
D.溴与NaOH溶液反应后,与溴苯分层.
解答 解:A.苯甲酸与CaO反应后,增大与苯甲醛的沸点差异,然后蒸馏分离,故A正确;
B.乙酸与NaOH溶液反应后,与乙醇互溶,然后蒸馏分离,故B错误;
C.乙烷中易引入新杂质氢气,应选溴水、洗气除杂,故C错误;
D.溴与NaOH溶液反应后,与溴苯分层,然后利用分液漏斗分液可除杂,故D正确;
故选AD.
点评 本题考查混合物分离提纯,为高频考点,把握物质的性质、性质差异及混合物分离方法为解答的关键,侧重分析与应用能力的考查,题目难度不大.

练习册系列答案
相关题目
3.在一定温度下的定容密闭容器中,以下说法能表明反应:A(s)+2B(g)?C(g)+D(g)已达平衡的是( )
| A. | 混合气体的压强不变 | B. | 混合气体的密度变小 | ||
| C. | 每消耗2molB,同时消耗1molC | D. | C和D的浓度比不变 |
4.下图是实验室制备氯气并进行一系列相关实验的装置(夹持及加热仪器已略).
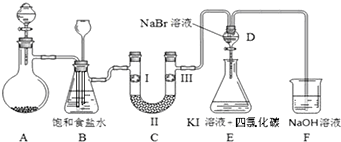
(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
(4)设计装置D、E的目的是比较氯、溴、碘单质的氧化性强弱.当向D中缓缓通入一定量氯气时,可以看到无色溶液逐渐变为橙黄色,打开D装置中活塞,将D中少量溶液加入装置E中,振荡.观察到的现象是溶液分层,上层接近无色,下层(四氯化碳层)为紫红色.经认真考虑,有同学提出该实验方案仍有不足,请说明其中不足的原因是氯气氧化性也强于碘,若通入Cl2过量,可能是过量氯气置换出I2.
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.

(1)制备氯气选用的药品为二氧化锰和浓盐酸,则相关的化学反应方程式为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O.
(2)装置B中饱和食盐水的作用是除去Cl2中的HCl.
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中Ⅰ、Ⅱ、Ⅲ依次放入d.
| a | b | c | d | |
| Ⅰ | 干燥的有色布条 | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| Ⅱ | 碱石灰 | 无水CaCl2 | 浓硫酸 | 无水CaCl2 |
| Ⅲ | 湿润的有色布条 | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
(5)装置F中用足量NaOH溶液吸收剩余的氯气,试写出相应的化学方程式:Cl2+2NaOH=NaCl+NaClO+H2O.
1.在下列溶液中Cl-的物质的量浓度最大的是( )
| A. | 0.5L 0.1mol/L的NaCl溶液 | B. | 100mL 0.2mol/L的MgCl2溶液 | ||
| C. | 1L 0.2mol/L的AlCl3溶液 | D. | 1L 0.3mol/L盐酸溶液 |
8.对于某些离子的检验及结论正确的是( )
| A. | 加盐酸有无色气体产生,该气体能使澄清石灰水变混浊,原溶液中一定有CO32- | |
| B. | 加氯化钡溶液有白色沉淀产生,再加盐酸,淀淀不消失,原溶液中一定有SO42- | |
| C. | 某溶液中加入Na2CO3溶液后有白色沉淀,则该溶液中一定有Ca2+ | |
| D. | 某溶液的焰色反应为黄色,则该溶液中一定有Na+ |
18.下列关于有机化合物的说法正确的是( )
| A. | 乙烯使KMnO4酸性溶液褪色是因为发生了氧化反应 | |
| B. | 甲烷和乙烯都可以与溴水反应 | |
| C. | 高锰酸钾可以氧化苯和甲烷 | |
| D. | 乙烯可以与氢气发生加成反应,苯也能与氢气加成 |
5.进行过滤操作应选用的一组仪器是( )
| A. | 漏斗、玻璃棒、烧杯、铁架台、滤纸 | B. | 烧杯、酒精灯、试管、漏斗 | ||
| C. | 滤纸、烧杯、试管夹、漏斗、玻璃棒 | D. | 玻璃棒、滤纸、烧瓶、漏斗、铁架台 |
2. 某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
 某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )
某化学教师为“氯气与金属钠反应”设计了如下装置与操作以替代相关的课本实验.实验操作:先给钠预热,到钠熔融成圆球时,撤火,通入氯气,即可见钠着火燃烧,并产生大量白烟.以下叙述错误的是( )| A. | 钠着火燃烧产生苍白色火焰 | |
| B. | 反应生成的大量白烟是氯化钠晶体 | |
| C. | 管中部塞一团浸有NaOH溶液的棉球是用于吸收过量的氯气 | |
| D. | 根据管右端棉球颜色的变化可判断氯气是否被碱液完全吸收 |
18.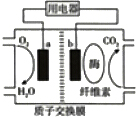 最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
 最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )
最近索尼公司演示了一种电池,可以采用碎纸运行,产生的废弃物就是水.该电池的电解质溶液中混合了水和酶,酶分解纸张会产生氢离子,氢离子与空气结合产生水,从而形成电流.其结构示意图如图所示,关于该电池的叙述正确的是( )| A. | 该电池属于燃料电池 | |
| B. | 该电池可在高温下使用 | |
| C. | a为该电池的负极 | |
| D. | b极附近的电极反应为:(C6H10O5)π+7nH2O+24ne-=6nCO2+24nH+ |