题目内容
【题目】研究![]() 之间的转化具有重要意义。
之间的转化具有重要意义。
(1)已知:![]()
![]()
将一定量![]() 气体充入恒容的密闭容器中,控制反应温度为
气体充入恒容的密闭容器中,控制反应温度为![]() 。
。
①下列可以作为反应达到平衡的判据是________。
A.气体的压强不变 B.![]() C.K不变
C.K不变
D.容器内气体的密度不变 E.容器内颜色不变
②![]() 时刻反应达到平衡,混合气体平衡总压强为p,
时刻反应达到平衡,混合气体平衡总压强为p,![]() 气体的平衡转化率为75%,则反应
气体的平衡转化率为75%,则反应![]() 的平衡常数
的平衡常数![]() ________(对于气相反应,用某组分B的平衡压强
________(对于气相反应,用某组分B的平衡压强![]() 代替物质的量浓度
代替物质的量浓度![]() 也可表示平衡常数,记作
也可表示平衡常数,记作![]() ,如
,如![]() ,p为平衡总压强,
,p为平衡总压强,![]() 为平衡系统中B的物质的量分数)。
为平衡系统中B的物质的量分数)。
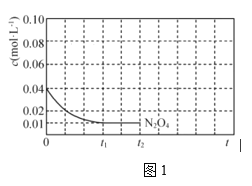
③反应温度![]() 时,
时,![]() 随t(时间)变化曲线如图1,画出
随t(时间)变化曲线如图1,画出![]() 时段,
时段,![]() 随t变化曲线____________。
随t变化曲线____________。
保持其它条件不变,改变反应温度为![]() ,再次画出
,再次画出![]() 时段,
时段,![]() 随t变化趋势的曲线。
随t变化趋势的曲线。
(2)![]() 氧化反应:
氧化反应:![]() 分两步进行,其反应过程能量变化示意图如图2。
分两步进行,其反应过程能量变化示意图如图2。
I ![]()
![]()
II ![]()
![]()
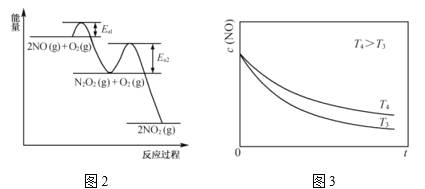
①决定![]() 氧化反应速率的步骤是________(填“I”或“II”)。
氧化反应速率的步骤是________(填“I”或“II”)。
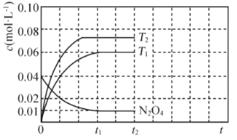
②在恒容的密闭容器中充入一定量的![]() 和
和![]() 气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得
气体,保持其它条件不变,控制反应温度分别为T3和T4(T4>T3),测得![]() 随t(时间)的变化曲线如图3。
随t(时间)的变化曲线如图3。
转化相同量的![]() ,在温度_________(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因________。
,在温度_________(填“T3”或“T4”)下消耗的时间较长,试结合反应过程能量图(图2)分析其原因________。
【答案】AE ![]()
 II
II ![]()
![]() ,温度升高,反应I平衡逆移,
,温度升高,反应I平衡逆移,![]() 减小;浓度降低的影响大于温度对反应II速率的影响
减小;浓度降低的影响大于温度对反应II速率的影响
【解析】
(1)①根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态。
②根据转化率求出平衡时各物质的物质的量分数,K![]() ,
,![]() ,p为平衡总压强,据此计算;
,p为平衡总压强,据此计算;
③根据平衡时N2O4的浓度求出平衡式NO2的浓度,t1~ t2平衡不移动,浓度不变;该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,据此分析;
(2)①正反应活化能较大的步骤决定整体反应速率;
②转化量相同,即c(NO2)相同;根据反应过程能量图可知![]() ,温度升高反应I平衡左移。
,温度升高反应I平衡左移。
(1)①A.恒容条件下平衡正向移动时压强增大,所以当压强不再变化时说明反应达到平衡,故A正确;
B.平衡时v正(N2O4) =v逆(N2O4) ;2v逆(N2O4) = v逆(NO2),故B错误;
C.温度不变K不变,故C错误;
D.容器内气体的质量不变,且恒容所以密度不会改变,故D错误;
E. NO2显红棕色,平衡正向移动颜色加深,故颜色不变时说明反应平衡,故E正确;
②恒容条件下压强比等于气体的物质的量之比,设初始时刻N2O4的物质的量为n,![]() 气体的平衡转化率为75%,则平衡时N2O4的物质的量为0.25n,生成的NO2的物质的量为1.5n,所以p(N2O4)=
气体的平衡转化率为75%,则平衡时N2O4的物质的量为0.25n,生成的NO2的物质的量为1.5n,所以p(N2O4)=![]() ,p(NO2)=
,p(NO2)=![]() ,K
,K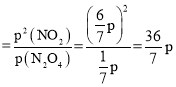 ;
;
③初始时刻充入一定量![]() ,c(N2O4)=0.04mol/L,则t0时刻c(NO2)=0,t1时刻反应达到平衡,平衡时c(N2O4)=0.01 mol/L,根据方程式可知c(NO2)= 0.06mol/L,t1~ t2平衡不移动,浓度不变;保持其它条件不变,升高温度至T2,该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,故再次平衡时c(NO2)>0.06mol/L,温度升高反应速率加快,达到平衡所需时间缩短,平衡时刻在t1时刻之前,故图象为:
,c(N2O4)=0.04mol/L,则t0时刻c(NO2)=0,t1时刻反应达到平衡,平衡时c(N2O4)=0.01 mol/L,根据方程式可知c(NO2)= 0.06mol/L,t1~ t2平衡不移动,浓度不变;保持其它条件不变,升高温度至T2,该反应焓变大于零,正反应为吸热反应,升高温度平衡右移,故再次平衡时c(NO2)>0.06mol/L,温度升高反应速率加快,达到平衡所需时间缩短,平衡时刻在t1时刻之前,故图象为:
 ;
;
(2)①根据反应过程能量图可知步骤II反应活化能较大,起决定因素;
②据图可知当c(NO2)相同时,T4温度下消耗的时间较长;![]() ,温度升高,反应I平衡逆移,
,温度升高,反应I平衡逆移,![]()