题目内容
13.某二元酸H2A电离方程式是:H2A=H++HA-,HA-?A2-+H+,下列说法正确的( )| A. | 无法确定NaHA溶液的酸碱性 | |
| B. | NaHA溶液中:c(H+)=c(A2-)+c(OH-) | |
| C. | 若0.1mol/L NaHA溶液的pH=2,则0.1mol/L H2A溶液中c(H+)=0.11mol/L | |
| D. | 常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合所得溶液pH=7 |
分析 A.根据电离方程式知,该二元酸第一步电离是完全电离、第二步是部分电离,所以HA-只能电离不能水解,导致NaHA溶液呈酸性;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒和物料守恒判断;
C.0.1mol•L-1H2A溶液,H2A=H++HA-,第一步完全电离,所以第一步电离出H+等于0.1mol/L,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离;
D.常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合,二者恰好反应生成Na2A和水,生成的盐是强碱弱酸盐,其水溶液呈碱性.
解答 解:A.根据电离方程式知,该二元酸第一步电离是完全电离、第二步是部分电离,所以HA-只能电离不能水解,导致NaHA溶液中c(H+)>c(OH-),所以溶液呈酸性,故A错误;
B.任何电解质溶液中都存在电荷守恒和物料守恒,根据电荷守恒得c( Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),根据物料守恒得c( Na+)=c(HA-)+c(A2-),所以得c(H+)=c(OH-)+c(A2-),故B正确;
C.0.1mol•L-1H2A溶液,H2A=H++HA-,第一步完全电离,所以第一步电离出H+等于0.1mol/L,0.1mol•L-1NaHA溶液的pH=2,则由HA-?H++A2-可知,电离出0.01mol/LH+,但第一步电离生成的H+抑制了HA-的电离,所以溶液中氢离子的物质的量浓度小于0.11mol/L,故C错误;
D.常温下1mol/L NaHA溶液与1mol/L NaOH溶液等体积混合,二者恰好反应生成Na2A和水,生成的盐是强碱弱酸盐,酸根离子水解导致其水溶液呈碱性,溶液的pH>7,故D错误;
故选B.
点评 本题考查弱电解质的电离、离子浓度大小比较等知识点,为高频考点,明确该二元酸的第一步、第二步电离程度是解本题关键,注意该溶液中不存在H2A分子,为易错点.

| A. | 二氧化氮会导致酸雨和光化学烟雾,危害较大 | |
| B. | 铝制品不宜用于盛放酸、碱溶液,不宜长时间盛放咸菜等腌制食品 | |
| C. | 人体中极少量的NO 会促进血管扩张,防止血管栓塞 | |
| D. | 利用铝热反应可实现工业制镁 |
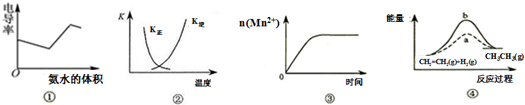
| A. | 图①表示25℃时,向盐酸和醋酸混合溶液中滴入氨水过程中电导率(表征溶液导电能力大小的物理量)的变化关系 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)═2SO3(g);△H<0 正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10mL 0.01mol•L-1 KMnO4 酸性溶液与过量的0.1mol•L-1 H2C2O4溶液混合时,n(Mn2+) 随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2=CH2(g)+H2(g)→CH3CH3(g);△H<0使用和未使用催化剂时,反应过程中的能量变化 |
| A. | 1:1 | B. | 54:63 | C. | 56:65 | D. | 65:56 |
| A. | FeCl3 | B. | CuSO4 | C. | FeSO4 | D. | NaCl |
a、酯化反应,b、取代反应,c、消去反应,d、加成反应,e、水解反应.其中能在有机物分子中引入羟基官能团的反应正确组合是( )
| A. | a、b、c | B. | d、e | C. | b、d、e | D. | b、c、d、e |

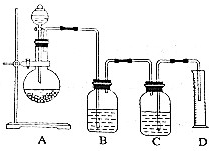 实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.
实验室可利用该装置来制取氯气,发生反应的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O.