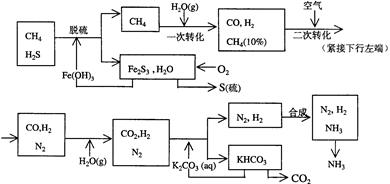
题目内容
TiO2俗称钛白粉,用途广泛,现正广泛开发,将来有机会成为新工业。工业上利用TiO2制备金属钛的流程如下。
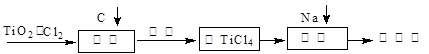
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
回答下列问题:
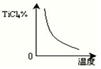
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)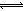 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。

(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)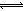 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
(4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
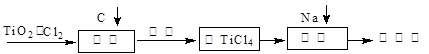
已知:I.
Ti(s)+O2(g)=TiO2(s) △H=-946 kJ·mol-1
2C(s)+O2(g)=2CO(g) △H=-221 kJ·mol-1
Ti(s)+2Cl2(g)=TiCl4(g) △H=-815 kJ·mol-1
II.某温度下各物质的沸点如下:
| 物质 | TiCl4 | FeCl3 | SiCl4 | AlCl3 |
| 沸点/℃ | 136 | 310 | 56.5 | 180 |
回答下列问题:
(1)在氯化工序中发生反应:TiO2(s)+2Cl2(g)+2C(s)
 TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
TiCl4(g)+2CO (g) 。试计算其反应的△H= kJ?mol-1;反应的平衡常数表达式K= ,在下图中作出TiCl4达到平衡后百分含量随温度的变化趋势图。
(2)氯化过程中带入的副产物有FeCl3、SiCl4和AlCl3,可用 方法获得较纯净的TiCl4。
(3)TiO2与Cl2反应:TiO2(s)+2Cl2(g)
 TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因
TiCl4(l)+O2(g)△H=+151kJ?mol-1。该反应在高温条件下但难以发生,但加入碳后反应能顺利进行,试解析上述原因 (4)还原工序要在惰性气体的气氛中进行的理由是_______________________。
(5)制取Ti的新工艺是用二氧化钛作阴极,以石墨为阳极,以CaCl2熔盐做电解质(在熔融状态下能传导O2-),电解而得到Ti,该工艺具有操作简单,成本低,无污染等优点,写出电解制备金属钛时阴极的电极反应式: 。
(16分)
(1)—90 (2分);
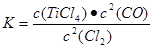 (平衡常数2分,作图2分,共4分)
(平衡常数2分,作图2分,共4分)
(2)蒸馏(分馏) (2分)
(3)降低生成物O2浓度,平衡向正方向移动 (或者碳与氧气反应放热,升高温度,导致平衡向吸热反应方向或正反应方向移动,3分)
(4)防止高温下Na(Ti)与空气中的O2(或CO2)作用(2分)
(5)TiO2+4e-=Ti+2O2- (3分)
(1)—90 (2分);
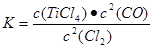 (平衡常数2分,作图2分,共4分)
(平衡常数2分,作图2分,共4分)
(2)蒸馏(分馏) (2分)
(3)降低生成物O2浓度,平衡向正方向移动 (或者碳与氧气反应放热,升高温度,导致平衡向吸热反应方向或正反应方向移动,3分)
(4)防止高温下Na(Ti)与空气中的O2(或CO2)作用(2分)
(5)TiO2+4e-=Ti+2O2- (3分)
试题分析:(1)先将已知热化学方程式编号为①②③,观察发现③—①+②可以约去Ti(s)、O2(g),根据盖斯定律,可以得到热化学方程式:TiO2(s)+2Cl2(g)+2C(s)
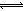 TiCl4(g)+2CO (g) △H=-90 kJ·mol-1;根据平衡常数定义可知,
TiCl4(g)+2CO (g) △H=-90 kJ·mol-1;根据平衡常数定义可知, ;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
;由于正反应的△H=-90 kJ·mol-1,正反应是放热反应,升高温度,平衡向吸热反应方向或逆反应方向移动,则TiCl4的百分含量逐渐减小,即随着温度的升高,TiCl4的百分含量逐渐减小;(2)读表中信息,TiCl4的沸点与杂质相差较大,因此可以利用沸点差异大的性质,选择蒸馏或分馏进行分离提纯;(3)从外界条件对化学平衡移动的角度分析,加入碳后,碳能与氧气反应生成二氧化碳,即C(s)+O2(g)=CO2(g),减小氧气浓度,使平衡向正反应方向移动;同时碳与氧气反应放出热量,使体系温度升高,由于正反应是吸热反应,则升温平衡向正反应方向移动;(4)还原工序中加入的钠是强氧化剂,容易被空气中氧气或水、二氧化碳等物质氧化,在惰性气体氛围中能防止高温下Na(Ti)与空气中的O2(或CO2)作用,提高钛的产率;(5)根据电解原理,阴极的主要反应物和产物分别是二氧化钛和单质钛,即TiO2→Ti;由于钛元素由+4价降为0价,得到4个电子,则TiO2+4e—→Ti;由于内电路中熔融电解质中氧离子可以传导,因此用氧离子使左右电荷守恒,即TiO2+4e—→Ti+2O2—;所以,阴极反应式为TiO2+4e-=Ti+2O2-。
练习册系列答案
相关题目
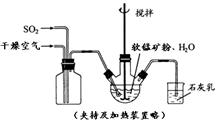
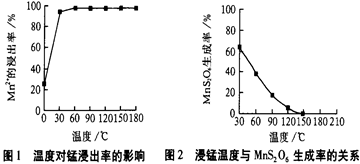
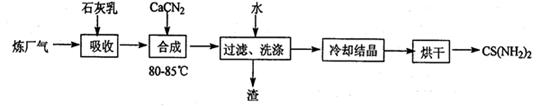
 2H2(g)+S2(g),其平衡常数表达式为K=。
2H2(g)+S2(g),其平衡常数表达式为K=。