题目内容
3.已知一元酸(HX)和一元碱(YOH),请回答下列问题:若25℃时,酸(HX)溶液、碱(YOH)溶液的浓变都为0.1mol•L-1,且等体积混合时得到混合溶液pH=9.(1)在相同浓度、相同温度下,HX的电离程度小于(填“大于”“小于”或“等于”)YOH的电离程度.
(2)写出HX与氢氧化钠溶液反应的离子方程式:HX+OH-=H2O+X-.
分析 (1)由于酸(HX)和碱(YOH)均为一元,在25℃时,酸(HX)溶液、碱(YOH)溶液的浓变都为0.1mol•L-1,等体积混合时两者的物质的量相同,则能恰好完全反应得到YX盐溶液,此时溶液的pH=9,则说明YX为强碱弱酸盐,据此分析HX和YOH的电离程度;
(2)由于HX为弱酸,故书写离子方程式时不能拆.
解答 解:(1)由于酸(HX)和碱(YOH)均为一元,在25℃时,酸(HX)溶液、碱(YOH)溶液的浓变都为0.1mol•L-1,等体积混合时两者的物质的量相同,则能恰好完全反应得到YX盐溶液,此时溶液的pH=9,则说明YX为强碱弱酸盐,即HX为弱酸,部分电离,而HY为强碱,完全电离,则HX的电离程度小于YOH的电离程度,故答案为:小于;
(2)由于HX为弱酸,故书写离子方程式时不能拆,则与氢氧化钠反应的离子方程式为:HX+OH-=H2O+X-.故答案为:HX+OH-=H2O+X-.
点评 本题依托等物质的量的一元酸和一元碱混合后显碱性,从而可知所生成的盐为强碱弱酸盐,来分析酸和碱的电离程度,难度不大.

练习册系列答案
 53随堂测系列答案
53随堂测系列答案
相关题目
13.在探究某地刚落下的酸雨成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A. | 在酸雨试样中加入Ba(NO3)2溶液有白色沉淀,说明酸雨中一定含SO42- | |
| B. | 将酸雨试样浓缩后加入Cu和浓H2SO4,试管口有红棕色气体,逸出说明酸雨中可能含NO3- | |
| C. | 每隔1 h测定酸雨试样的pH,其pH先变小后不变,说明刚落下的酸雨中含SO32- | |
| D. | 用玻璃棒蘸取酸雨,在酒精灯上灼烧,火焰呈黄色,说明酸雨中一定存在Na+ |
18.某地酸雨经检验除含H+外[C(OH)-以及其他微量的离子浓度忽略]还有Na+,Cl-,NH4+,SO42-其浓度见表:
(1)试计算混合液中H+的浓度3.5×10-3mol•L-1.
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
| 离子种类 | Na+ | Cl- | NH4+ | SO42- |
| 离子浓度 | 2.3×10-5mol/L | 3.5×10-5mol/L | 7×10-6mol/L | 2.4×10-6mol/L |
(2)取1mL该酸雨,若完全反应消耗NaOH的物质的量为3.5×10-6mol.
(3)若只用一份该酸雨样品检验其中Cl-和SO42-应先加Ba(OH)2(填化学式)待沉淀完全后再加AgNO3(填化学式).
(4)在问题(3)中判断已沉淀完全可加第二份沉淀剂的具体操作方法为取加入氢氧化钡以后的溶液少量,向其中加入少量的盐酸,看是否产生无色气体,若没有气体产生,证明硫酸根离子沉淀完全.
8.实验室需要配制离子浓度均为1mol•L-1,下列离子的溶液,你认为能配制成功的是( )
| A. | Al3+、NO3-、K+、SO42- | B. | Cu2+、Ba2+、SO42-、CO32- | ||
| C. | OH-、Cl-、NH4-、Na+ | D. | Mg2+、Na+、SO42-、NO3- |
3.CuS04是一种重要的化工原料,其有关制备途径及性质如图所示.下列说法不正确的是( )


| A. | 相对于途径①,途径②更好地体现了绿色化学思想 | |
| B. | Y可以是葡萄糖溶液 | |
| C. | 利用途径②制备16g硫酸铜,被还原的硫酸的物质的量为0.1mol | |
| D. | 途径①所用混酸中H2S04与HN03物质的量之比最好为3:2 |
20.将等物质的量的X、Y气体充入一个容积可变的密闭容器中,在一定条件下发生如下反应并达到平衡:X(g)+Y(g)?2Z(g);△H<0.当改变某个条件并维持新条件直至达到新平衡,下表中关于新平衡与原平衡的比较,正确的是( )
| 选择 | 改变的条件 | 正、逆反应速率变化 | 新平衡和原平衡比较 |
| A | 升高温度 | 逆反应速率增大量大于正反应速率增大量 | Z的体积分数变大 |
| B | 增大压强 | 正反应速率增大,逆反应速率减小 | Z的浓度不变 |
| C | 减小压强 | 正、逆反应速率都减小 | Y的体积分数变大 |
| D | 充入少量Z | 逆反应速率增大 | X的体积分数不变 |
| A. | A | B. | B | C. | C | D. | D |
1.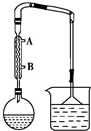 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
回答下列问题:
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.
 某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:
某课外兴趣小组以正丁醇为主要原料,利用图示装置制备1-溴丁烷.实验过程如下:Ⅰ制备:圆底烧瓶中依次加入5mL水、5mL浓硫酸、3.1mL正丁醇和4.2g NaBr,按如图安装反应装置,用小火加热混合物至沸腾,保持回流30min,在此过程中要不断摇动反应瓶;
Ⅱ分离:移去热源,稍冷后拆去回流装置,把装置改成普通蒸馏装置,接着进行蒸馏操作,得到粗产品;
Ⅲ提纯:粗产品经洗涤、干燥、蒸馏等操作,得到产品.
| 物质 | 颜色、状态 | 沸点(℃) | 密度(g•mL-1) | 水溶性 |
| 正丁醇 | 无色液体 | 117.2 | 0.8098 | 易溶 |
| 1-溴丁烷 | 无色液体 | 101.6 | 1.2758 | 难溶 |
(1)制备装置中冷凝管的作用是冷凝回流、导气,冷凝水的进水口为B(填“A”或“B”).
(2)加热回流后,反应瓶中的物料呈红棕色,其原因是2HBr+H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$Br2↑+SO2↑+2H2O(用化学方程式表示).
(3)在制备1-溴丁烷时不能边反应边蒸出产物,其原因是1-溴丁烷与正丁醇的沸点差较小,若边反应边蒸出产物,会有较多的正丁醇挥发,降低原料的利用率.
(4)要除去1-溴丁烷中含有的少量杂质Br2,下列物质中最适合的是C.
A.NaCl B.NaOH C.NaHSO3 D.KCl.