题目内容
14.250mL 0.1mol/L H2SO4溶液中.(1)含H2SO4的物质的量是多少?
(2)此时溶液中H+的物质的量浓度是多少?
分析 (1)根据n=cV计算硫酸的物质的量;
(2)n(H+)=2n(H2SO4),再根据c(H+)=$\frac{n}{V}$计算氢离子的浓度.
解答 解:(1)250mL 0.1mol/L H2SO4溶液中,硫酸的物质的量n=cV=0.1mol/L×0.25L=0.025mol,
答:硫酸的物质的量为0.025mol;
(2)n(H+)=2n(H2SO4)=0.05mol,
则溶液中H+的物质的量浓度是c(H+)=$\frac{n}{V}$$\frac{0.05mol}{0.25L}$=0.1mol/L;
答:溶液中H+的物质的量浓度是0.1mol/L.
点评 本题考查物质的量浓度有关计算,比较基础,注意对公式的理解与灵活应用,注意把握硫酸溶液中氢离子与硫酸的物质的量的关系.

练习册系列答案
 高中必刷题系列答案
高中必刷题系列答案
相关题目
4.下列物质中,物质的量最大的是( )
| A. | 4g H2 | B. | 18mL H2O (4℃时) | C. | 23g Na+ | D. | 6.02×1023个O |
5.下列说法错误的是( )
| A. | 配制0.1mol•L-1 NaOH溶液时,用潮湿的烧杯称量NaOH固体,对配制结果无影响 | |
| B. | 配制一定物质的量浓度溶液时,用量筒量取浓溶液体积仰视读数,所配溶液的浓度结果偏高 | |
| C. | 98%的浓硫酸用等体积的水稀释后,硫酸的质量分数为49% | |
| D. | 温度一定时,向饱和食盐水中加入固体氯化钠,则溶液的浓度和质量均不变 |
9.下列实验中,能发生离子反应的是( )
| A. | 氢气还原氧化铜 | B. | 盐酸与K2S04溶液混合 | ||
| C. | 降低饱和KNO3溶液的温度 | D. | K0H溶液与CuSO4溶液混合 |
12.国际无机化学命名委员会在1989年作出决定,把长式周期表原先的主、副族及族号取消,从左到右改为第 1~18列,第ⅠA族为第1列,稀有气体元素为第18列.按这个规定,下列说法不正确的是( )
| A. | 第3列所含元素种类最多 | B. | 第1列元素中全为金属元素 | ||
| C. | 第15的气态氢化物为RH3 | D. | 第17列元素的第一种元素无含氧酸 |
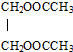 (过程中无机产物已忽略)
(过程中无机产物已忽略)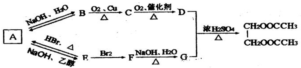 .
.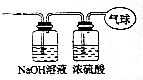 现有14.4g CO和CO2的混合气体,在标准状况下其体积为8.96L.回答下列问题:
现有14.4g CO和CO2的混合气体,在标准状况下其体积为8.96L.回答下列问题: