题目内容
【题目】1.06g某有机物A完全燃烧后,得到1.792 L CO2气体(标况)和0.9gH2O,该有机物对氢气相对密度是53。(第(1)1分(2)(3)各2分共5分)
(1)求该有机物的相对分子质量。
(2)求该有机物的分子式
(3)根据下述实验现象及结论是,确定该有机物的结构简式
①它不能与溴发生反应
②它能使KMnO4酸性溶液褪色
③它能发生硝化反应,当引入1个硝基时,只能得到1种硝基化合物。
【答案】

【解析】
(1)相对分子质量=该有机物对氢气相对密度*氢气相对分子质量
=53*2
=106
(2)1.06g某有机物A的物质的量n(A)=1.06g/106g·mol-1
=0.01mol
n(C)=1.792l/22.4L·mol-1
=0.08mol
n(H)=2*0.9g/18g·mol-1
=0.1mol
n(O)=(1.06g-0.08mol*12g·mol-1-0.1mol*1g·mol-1)/16g·mol-1
=0
所以A分子中C原子为0.08mol/0.01mol=8
A分子中H原子为0.1mol/0.01mol=10
该有机物的分子式C8H10
(3)由化学式可得该化合物的缺氢指4,可能为含苯环的化合物,由题意,滿足条件的是对二甲苯。

 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案【题目】硫酸铵是化工、染织、医药、皮革等工业原料。某硫酸工厂利用副产品Y处理尾气SO2得到CaSO4,再与相邻的合成氨工厂联合制备(NH4)2SO4,工艺流程如下:
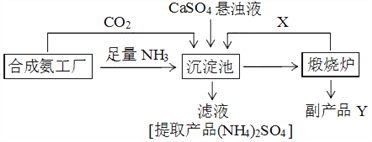
请回答以下问题:
(1)下列有关(NH4)2SO4溶液的说法正确的是_____
A.电离方程式:(NH4)2SO4![]() 2NH4++SO42-
2NH4++SO42-
B.水解离子方程式:NH4++H2O![]() NH3H2O+H+
NH3H2O+H+
C.离子浓度关系:c(NH4+)+c(H+)=c(SO42-)+c(OH–)
D.微粒浓度大小:c(NH4+)>c(SO42-)>c(H+)>c(NH3H2O)>c(OH–)
(2)硫酸工业中,V2O5作催化剂时发生反应2SO2+ O2 ![]() 2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
2SO3,SO2的转化率与温度、压强有关,请根据下表信息,结合工业生产实际,选择下表中最合适的温度和压强分别是__________。该反应420℃时的平衡常数_____520℃时的平衡常数(填“>”、“<”或“=”)。
| 1.01×105Pa | 5.05×105Pa | 1.01×106Pa |
420℃ | 0.9961 | 0.9972 | 0.9984 |
520℃ | 0.9675 | 0.9767 | 0.9852 |
620℃ | 0.8520 | 0.8897 | 0.9276 |
(3)在2L密闭容器中模拟接触法制备三氧化硫时,若第12分钟恰好达到平衡,测得生成SO3的物质的量为1.2mol,计算前12分钟用氧气表示反应速率v(O2)为___________。
(4)副产品Y是__。沉淀池中发生的主要反应方程式是___________________。
(5)从绿色化学和资源综合利用的角度说明上述流程的主要优点是________________。

