题目内容
6.设NA为阿伏加德罗常数的值.下列说法正确的是( )| A. | 78g由Na2S和Na2O2组成的固体混合物,含有的阴离子数为NA | |
| B. | 标准状况下,22.4L CCl4中含有的分子数为NA | |
| C. | 将1mol FeCl3水解制成胶体,所得胶体中含有的胶体粒子数为NA | |
| D. | 1mol/L NaOH溶液中含有的Na+数目为NA |
分析 A、Na2S和Na2O2的摩尔质量均为78g/mol,且均由2个阳离子和1个阴离子构成;
B、标况下,四氯化碳为液态;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体;
D、溶液体积不明确.
解答 解:A、Na2S和Na2O2的摩尔质量均为78g/mol,故78g混合物的物质的量为1mol,而两者均由2个阳离子和1个阴离子构成,故1mol混合物中含1mol阴离子即NA个,故A正确;
B、标况下,四氯化碳为液态,不能根据气体摩尔体积来计算其物质的量,故B错误;
C、一个氢氧化铁胶粒是多个氢氧化铁的聚集体,故1mol氯化铁制的胶粒的个数小于NA个,故C错误;
D、溶液体积不明确,故溶液中的钠离子的个数无法计算,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
16.0.5mol H2SO4的质量( )
| A. | 98g | B. | 49g | C. | 80g | D. | 32g |
17.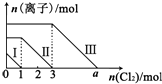 向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
 向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )
向仅含Fe2+、I-、Br -的溶液通入适量氯气,溶液中这三种离子的物质的量的变化如图所示.下列说法中正确的是( )| A. | 线段Ⅲ代表Fe2+的变化情况 | B. | 线段Ⅰ代表Br -的变化情况 | ||
| C. | 原混合溶液中n(FeBr2)=4mol | D. | a数值等于6 |
1.如图所示为气相直接水合法C2H4(g)+H2O(g)═C2H5OH(g)中乙烯的平衡转化率与温度、压强的关系[其中n(H2O):n(C2H4)=1:1].

计算乙烯水合制乙醇反应在图中A点的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压物质的量分数)( )

计算乙烯水合制乙醇反应在图中A点的平衡常数Kp为 (用平衡分压代替平衡浓度计算,分压=总压物质的量分数)( )
| A. | 0.082 | B. | 0.072 | C. | 0.072MPa-1 | D. | 0.082 MPa-1 |
11.下列叙述中正确的是( )
| A. | HClO是弱酸,所以NaClO是弱电解质 | B. | 水泥、玻璃、水晶属于硅酸盐材料 | ||
| C. | Na2O2的热稳定性大于NaHCO3 | D. | 金属钠着火时可用泡沫灭火器灭火 |
18.下列实验方案中,可行的是( )
| A. | 用氢氧化钠溶液除去CO2中的HCl气体 | |
| B. | 将白醋滴在湿润的pH试纸上,测定其pH | |
| C. | 按溶解、过滤、蒸发的操作顺序分离CaCl2、CaCO3的混合物 | |
| D. | 用BaCl2溶液除去KNO3溶液中少量的K2SO4 |