题目内容
将35.8 g Al、Fe、Cu组成的合金溶于足量的NaOH溶液中,产生6.72 L气体(标准状况)。另取等质量的该合金溶于过量的稀硝酸中,生成13.44 LNO(标准状况),向反应后的溶液中加入足量的NaOH溶液,得到沉淀的质量为 ( )
| A.50.8 g | B.66.4 g | C.44.8g | D.39.2g |
A
解析试题分析:在氢氧化钠溶液中发生反应:2Al+2NaOH+2H2O=2NaAlO2+3H2↑.n(H2)=6.72L÷22.4L/mol=0.3mol.所以n(Al)=0.2mol.m(Al)=5.4g,原混合物中铁、铜的质量和是30.4g在硝酸中发生反应:Al+4HNO3=Al(NO3)3+NO↑+2H2O;Fe++4HNO3=Fe(NO3)3+NO↑+2H2O;3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O.向反应后的溶液中加入足量的NaOH溶液,得到沉淀是氢氧化铝和氢氧化铜沉淀。铝与硝酸反应放出NO气体的物质的量为0.2mol.n(NO)总=13.44L÷22.4L/mol=0.6mol.所以;铁、铜与硝酸反应放出NO气体是0.4mol.可根据铁、铜的质量和是30.4g及;铁、铜与硝酸反应放出NO气体是0.4mol计算出铁、铜的质量,进而得到产生的沉淀的质量。选项为:A。
考点:考查Al Fe Cu单质及化合物的性质的知识。

下列关于SO2性质的说法中,不正确的是
| A.能使品红溶液褪色 | B.能与水反应生成硫酸 |
| C.能与NaOH溶液反应 | D.能使酸性KMnO4溶液褪色 |
下列说法错误的是( )
| A.制造水泥和玻璃都用到的原料是CaCO3 |
| B.为了调节水泥的硬化速度,制造水泥时需要加入石膏 |
| C.当水泥、沙子与水调成水泥浆时,水泥浆对皮肤有腐蚀作用,这是因为水泥浆呈较强的碱性 |
| D.水泥、玻璃、陶瓷都是混合物,具有较高的熔点 |
实验表明:将氯水滴加到一张蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是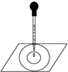
| A.此实验表明氯水具有酸性、漂白性 |
| B.内环呈白色外环呈红色或浅红 |
| C.内外环上颜色的差异表明此变化过程中,中和反应比氧化还原反应快 |
| D.氯水中形成次氯酸的反应中还原产物是HClO |
已知反应:①2Cl2+HgO=HgCl2+X,②X+H2O=2Y,其中X是一种黄绿色气体。下列说法中不正确的是( )
| A.Y能使湿润的有色布条褪色 |
| B.反应①是置换反应 |
| C.用强光照射Y时,Y会发生分解反应 |
| D.反应②不是氧化还原反应 |
在标准状况下,向100 mL氢硫酸溶液中通入二氧化硫气体,溶液pH变化如图所示,则原氢硫酸溶液的物质的量浓度为
| A.0.5 mol/L | B.0.05 mol/L | C.1 mol/L | D.0.1 mol/L |
下列对氯气的性质及实验现象描述不正确的是
①钠在氯气中燃烧时产生白烟;②氢气在氯气中燃烧发出淡蓝色的火焰;③红热的铜丝在氯气中燃烧发出棕黄色的雾;④氯气跟水反应生成盐酸和次氯酸;⑤氯气有毒,液氯无毒
| A.①② | B.②③⑤ | C.②③④ | D.①④ |
氯气是一种重要的工业原料。工业上利用反应3Cl2+2NH3=N2+6HCl检查氯气管道是否漏气。下列说法错误的是(注意:HCl与NH3极易反应而生成白烟) ( )
| A.若管道漏气遇氨就会产生白烟 | B.该反应利用了Cl2的强氧化性 |
| C.该反应属于复分解反应 | D.生成1 mol N2有6 mol电子转移 |
NH3是重要的化工原料,可以制备一系列物质(如图所示)。下列说法正确的是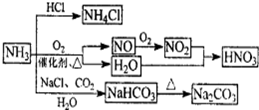
| A.NH4Cl和NaHCO3都是常用的化肥 |
| B.NH4Cl、HNO3和Na2CO3受热时都易分解 |
| C.NH3和NO2在一定条件下可发生氧化还原反应 |
| D.图中所涉及的盐类物质均可以发生水解反应 |