题目内容
【题目】某化学兴趣小组为探究SO2的性质,按如图所示装置进行实验. 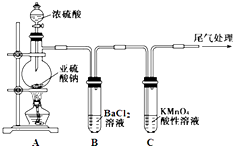
已知:Na2SO3+H2SO4(浓) ![]() Na2SO4+SO2↑+H2O
Na2SO4+SO2↑+H2O
请回答下列问题:
(1)装置A中盛放浓硫酸的仪器名称是 .
(2)实验过程中,C中的现象是 , 说明SO2具有性.
(3)实验过程中,观察到装置B中出现了明显的白色沉淀.为探究该白色沉淀的成分,该小组同学进行了如下实验: ![]()
根据实验事实判断该白色沉淀的成分是(填化学式),产生该白色沉淀的原因可能是(填字母编号).
a.BaSO3既不溶于水也不溶于酸 b.BaCl2溶液中可能溶解有氧气
c.BaCl2溶液中可能混有NaOH d.由A制得的SO2气体中可能混有氧气
(4)如果将装置A中的浓H2SO4换作浓HNO3 , 对此实验是否有影响并明理由 .
【答案】
(1)分液漏斗
(2)KMnO4溶液褪色;还原
(3)BaSO4;bd
(4)有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体
【解析】解:(1)该仪器名称是分液漏斗,所以答案是:分液漏斗; (2)二者反应生成锰离子和硫酸根离子而使高锰酸钾溶液褪色,通过该反应说明二氧化硫具有还原性,该反应说明二氧化硫具有还原性,所以答案是:KMnO4溶液褪色;还原;(3)硫酸钡不溶于酸和水,亚硫酸钡易溶于酸,该沉淀不溶于稀盐酸,说明沉淀是硫酸钡;
二氧化硫具有还原性,在水溶液里能被氧化剂氧化生成硫酸根离子,所以二氧化硫或氯化钡溶液中可能含有氧气将二氧化硫氧化为硫酸根离子,故选bd;
所以答案是:BaSO4;bd;(4)浓硫酸具有强氧化性,但不能氧化亚硫酸钠,浓硝酸具有强氧化性,能将亚硫酸钠氧化物硫酸钠而得不到二氧化硫,所以不能将浓硫酸换为浓硝酸,所以答案是:有影响,浓HNO3可将亚硫酸钠氧化为硫酸钠,而得不到SO2气体.