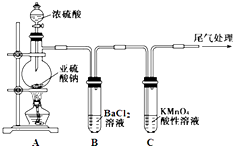
题目内容
【题目】常温下,A、B、C、D为中学化学常见单质,B为黄绿色气体,C为无色气体,在一定条件下转化关系如图(部分生成物略去);其中F为淡黄色化合物,H为红褐色沉淀c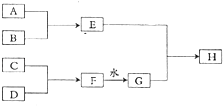
回答下列问题:
(1)C的化学式
(2)F→G反应的化学方程式
(3)向E溶液中通入一定量虽的SO2气体,溶液由黄色变为浅绿色.①浅绿色溶液中一定大量存在的离子有H+、Cl﹣和 .
②某同学认为反应后的溶液中可能存在H2SO3 , 应选择以下试剂(填写序号)加以检验.
A.稀硫酸 B.NaOH溶液C.KSCN溶液D.品红溶液
(4)某温度下,将B(设B的化学式为X2)通入NaOH溶液中,反应得到NaX、NaXO、NaXO3的混合液,经测定XO﹣与XO ![]() 的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
的浓度之比为5:1,则X2与NaOH溶液反应时被还原的X元素与被氧化的X元素的物质的量之比为
(5)少量D在实验室中的保存方法是
(6)B的氢化物的水溶液不与Cu反应.若再加入H2O2后,则可使铜顺利溶解.该反应的化学方程式为: .
【答案】
(1)O2
(2)2Na2O2+2H2O=4NaOH+O2↑
(3)Fe2+、SO ![]() ;D
;D
(4)5:3
(5)保存在煤油中
(6)Cu+H2O2+2HCl=CuCl2+2H2O
【解析】解:B为黄绿色气体,应为Cl2 , F为淡黄色化合物,应为Na2O2 , 由转化关系可知G为NaOH,H为红褐色沉淀,应为Fe(OH)3 , 则E为FeCl3 , A为Fe,C为无色气体,应为O2 , 则D为Na,(1)由以上分析可知C为O2 , 所以答案是:O2;(2)F→G的反应为过氧化钠和水,生成氢氧化钠和氧气,方程式为2Na2O2+2H2O=4NaOH+O2↑,所以答案是:2Na2O2+2H2O=4NaOH+O2↑;(3)①由信息可知,发生2Fe3++SO2+H2O═2Fe2++SO ![]() +H+ , 则浅绿色溶液中一定存在的离子有H+、Cl﹣和Fe2+、SO
+H+ , 则浅绿色溶液中一定存在的离子有H+、Cl﹣和Fe2+、SO ![]() ,所以答案是:Fe2+、SO
,所以答案是:Fe2+、SO ![]() ;②如果存在亚硫酸,亚硫酸分解生成二氧化硫和水,二氧化硫具有漂白性,能使品红溶液褪色,亚硫酸和稀硫酸、KSCN溶液不反应,和NaOH反应无明显现象,所以答案是:D;(4)Cl2生成ClO﹣与ClO
;②如果存在亚硫酸,亚硫酸分解生成二氧化硫和水,二氧化硫具有漂白性,能使品红溶液褪色,亚硫酸和稀硫酸、KSCN溶液不反应,和NaOH反应无明显现象,所以答案是:D;(4)Cl2生成ClO﹣与ClO ![]() 是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO﹣与ClO
是被氧化的过程,化合价分别由0价升高为+1价和+5价,ClO﹣与ClO ![]() 的物质的量浓度之比为5:1,则可设ClO﹣为5mol,ClO
的物质的量浓度之比为5:1,则可设ClO﹣为5mol,ClO ![]() 为1mol,被氧化的Cl共为6mol, 失去电子的总物质的量为5mol×(1﹣0)+1mol×(5﹣0)=10mol,
为1mol,被氧化的Cl共为6mol, 失去电子的总物质的量为5mol×(1﹣0)+1mol×(5﹣0)=10mol,
氧化还原反应中氧化剂和还原剂之间得失电子数目相等,
Cl2生成NaCl是被还原的过程,化合价由0价降低为﹣1价,
则得到电子的物质的量也应为10mol,
则被还原的Cl的物质的量为10mol,
所以被还原的氯元素和被氧化的氯元素的物质的量之比为10mol:6mol=5:3,
所以答案是:5:3;(5)钠性质活泼,易与水、氧气反应,但密度比煤油大,可与煤油反应,所以答案是:保存在煤油中;(6)双氧水具有氧化性,在酸性环境下能将金属铜氧化,方程式为:Cu+H2O2+2HCl=CuCl2+2H2O,所以答案是:Cu+H2O2+2HCl=CuCl2+2H2O.

【题目】某研究性学习小组用工业碳酸钙(主要成分为CaCO3;杂质为:Al2O3、FeCO3) 为原料,先制备无机钙盐,再与甲酸钠溶液混合制取甲酸钙.结合如图几种物质的溶解度曲线及表中相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为1.0molL﹣1计算),现提供的试剂有:a.甲酸钠,b.5molL﹣1硝酸,c.5molL﹣1盐酸,d.5molL﹣1硫酸,e.3%H2O2溶液,f.澄清石灰水.
金属离子 | 开始沉淀的pH | 沉淀完全的pH |
Fe3+ | 1.1 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
请补充完整由碳酸钙制备甲酸钙的实验步骤
步骤1.称取13.6g甲酸钠溶于约20mL水,配成溶液待用,并称取研细的碳酸钙样品10g待用.
步骤2. .
步骤3. .
步骤4.过滤后,将滤液与甲酸钠溶液混合,调整溶液pH 7~8,充分搅拌,所得溶液经、、洗涤干燥得甲酸钙晶体.