题目内容
能正确表示下列化学反应的离子方程式的是( )
分析:A.醋酸为弱酸,应写成化学式;
B.澄清石灰水中Ca(OH)2完全电离成离子;
C.电荷不守恒;
D.碳酸钙不溶于水,与过量的稀盐酸反应生成CO2和H2O.
B.澄清石灰水中Ca(OH)2完全电离成离子;
C.电荷不守恒;
D.碳酸钙不溶于水,与过量的稀盐酸反应生成CO2和H2O.
解答:解:A.醋酸为弱酸,应写成化学式,反应的离子方程式为Fe+2HAc=Fe2++H2↑+2Ac-,故A错误;
B.澄清石灰水与稀盐酸反应的离子方程式为OH-+H+═H2O,故B错误;
C.铜片插入硝酸银溶液中反应的离子方程式为Cu+2Ag+═Cu2++2Ag,故C错误;
D.碳酸钙不溶于水,与过量的稀盐酸反应生成CO2和H2O,反应的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故D正确.
故选D.
B.澄清石灰水与稀盐酸反应的离子方程式为OH-+H+═H2O,故B错误;
C.铜片插入硝酸银溶液中反应的离子方程式为Cu+2Ag+═Cu2++2Ag,故C错误;
D.碳酸钙不溶于水,与过量的稀盐酸反应生成CO2和H2O,反应的离子方程式为CaCO3+2H+═Ca2++H2O+CO2↑,故D正确.
故选D.
点评:本题考查离子放出的书写,题目难度中等,本题注意物质的化学式与离子符号的判断,书写离子方程式时要注意电荷守恒等问题.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
在下列各说法中,正确的是( )
| A、对于2SO2(g)+O2(g)?2SO3(g)△H=-QkJ?mol-1,(Q>0),若反应中充入1molSO2和足量的氧气反应时,放出的热量一定是Q/2 kJ | B、热化学方程式中的化学计量数不能用分数表示 | C、Zn(s)+H2SO4(aq)═ZnSO4(aq)+H2(g)△H<0,该反应的化学能可以转化为电能 | D、△H的大小与热化学方程式的化学计量数无关 |
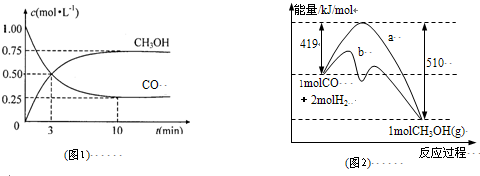
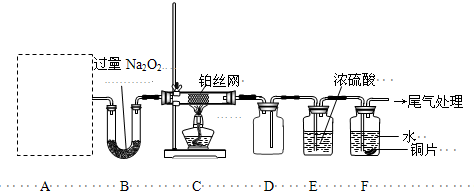
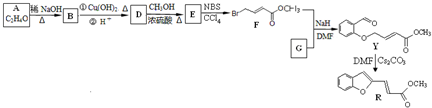
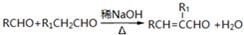 (R、R1表示烃基或氢)
(R、R1表示烃基或氢)
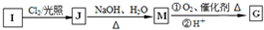


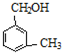 互为同系物
互为同系物