题目内容
【题目】下图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极。通电一段时间后,在c、d两极上共收集到336ml(标准状况)气体。回答下列问题:
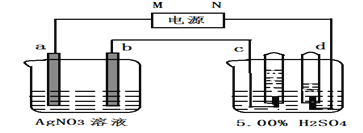
(1)根据图中c、d两极上产生气体的体积判断电源N极为_______极(填“正”或“负),电解池中a为______极。请写出a极的电极反应式:___________________.
(2) AgNO3溶液的浓度________(填“增大”“减小”或“不变”,下同),AgNO3溶液的pH_________,H2SO4溶液的浓度__________,H2SO4溶液的pH________.
(3)上述过程中通过电路的电子______mol.
(4)若H2SO4溶液中溶质的质量分数由5.00%变为5.02%,则原有的5.00%溶液为____g.
【答案】 负 阳 Ag- e- =Ag+ 不变 不变 增大 减小 0.02 45.18
【解析】本题主要考查有关电解池的概念和计算。
(1)c产生的气体体积较少,该气体是氧气,c是阳极,d是阴极,所以电源N极为负极,电解池中a为阳极。a极的电极反应式:Ag-e-=Ag+。
(2)AgNO3溶液的浓度不变,AgNO3溶液的pH不变,右装置电解水,H2SO4溶液的浓度增大,H2SO4溶液的pH减小。
(3)在c、d两极上共收集到336ml(标准状况)气体的物质的量为0.015mol,其中2/3即0.01mol为氢气,H2~2e-,所以上述过程中通过电路的电子为0.02mol.
(4)在c、d两极上共得到0.015mol气体,对应消耗0.01mol即0.18g水。设原有5.00%溶液的质量为xg,H2SO4溶液中溶质的质量分数由5.00%变为5.02%,根据电解前后溶质质量不变可得5.00%x=5.02%(x-0.18),x=45.18,则原有的5.00%溶液为45.18g。