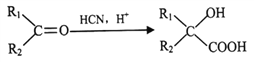
题目内容
【题目】某化学兴趣小组同学在查阅资料的基础上对乙醛与新制氢氧化铜的反应进行了探究。
(1)乙醛与新制氢氧化铜反应的化学方程式为________。
(查阅资料)i.乙醛在碱性条件下可发生缩合等反应生成有色物质;ii.溶液的酸碱性可能会影响物质的氧化性、还原性。
(初步探究)
序号 | 实验操作 | 实验现象 |
I | 向试管中加入4 mL 10 % NaOH溶液,滴入0.5 mL 水,加入0.5 mL 40 %乙醛溶液,振荡;在酒精灯上加热至沸腾后保持沸腾 | 无色溶液逐渐变黄,并变浑浊;加热后得黄色浊液,之后无明显变化 |
II | 向试管中加入4 mL 10 % NaOH溶液,滴入0.5 mL 2 %CuSO4溶液,振荡;加入0.5 mL 40 %乙醛溶液,振荡;在酒精灯上加热至沸腾后保持沸腾 | 蓝色浊液依次呈绿色、黄色、橙色,最终生成红色固体;之后无明显变化 |
III | 向试管中加入4 mL水,滴入0.5 mL 2 %CuSO4溶液,振荡;加入0.5 mL 40 %乙醛溶液,振荡;在酒精灯上加热至沸腾后保持沸腾 | 蓝色溶液无明显变化 |
(2)实验I的目的是________。
(3)甲同学为了检验实验II中红色固体的成分进行了如下实验:取少量红色固体于试管中,加入适量稀HNO3,振荡,观察到红色固体完全溶解,得蓝色溶液。甲同学认为,该实验现象说明实验II中反应生成了Cu。乙同学认为甲的观点不正确,理由是_____。
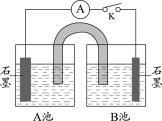
(深入探究)乙同学对比实验II和实验III,对实验II能够发生反应的原因提出了猜想:乙醛的还原性随着溶液碱性的增强而增强,并利用实验IV进行验证。
实验装置 | 序号 | A池试剂 | B池试剂 | 实验现象 |
| IV-1 | 0.2% CuSO4溶液 | Na2SO4溶液和40%乙醛溶液按体积比9:1混合 | 指针不偏转,A、B池中均无明显变化 |
IV-2 | 0.2% CuSO4溶液 |
(4)实验IV-1中,Na2SO4溶液的作用是________。
(5)实验IV-2中,B池中的试剂是________。
(6)根据实验现象,乙同学认为其猜想成立。乙同学观察到的实验现象是________。
(7)综合上述实验,小组同学经过深入讨论,认为除了乙同学的猜想外,与实验III相比,实验II能够发生反应的原因还可能有________和________。
【答案】CH3CHO + 2Cu(OH)2+ NaOH→CH3COONa + Cu2O↓+ 3H2O 排除乙醛在碱性条件下发生缩合等反应生成有色物质对实验II的干扰 Cu2O也可能被硝酸氧化为Cu2+,产生“红色固体完全溶解,得蓝色溶液”的现象 使B池溶液具有导电性,同时保证中性环境,与实验IV-2对比 10% NaOH溶液、40%乙醛溶液、蒸馏水按体积比8:1:1混合 指针偏转,A池中(或A池电极上)生成红色固体 Cu(II)在碱性条件下氧化性增强【或Cu(OH)2的氧化性强于CuSO4】 乙醛缩合反应产物的还原性强于乙醛
【解析】
(1)乙醛被新制氢氧化铜氧化为醋酸钠;
(2)实验I与实验II做对比;
(3)Cu、Cu2O都是红色固体,都能溶于硝酸生成蓝色硝酸铜溶液;
(4)乙醛是非电解质,乙醛溶液不导电;
(5)实验目的是验证乙醛的还原性随着溶液碱性的增强而增强;根据控制变量法,增大氢氧化钠浓度,并保证乙醛浓度相等。
(6)增大氢氧化钠浓度,乙醛的还原性增强,A中CuSO4被还原;
(7).对比实验III、实验II的条件不同进行分析。
(1)乙醛被新制氢氧化铜氧化为醋酸钠,反应的方程式是CH3CHO + 2Cu(OH)2+ NaOH→CH3COONa + Cu2O↓+ 3H2O;
(2)实验I与实验II做对比,排除乙醛在碱性条件下发生缩合等反应生成有色物质对实验II的干扰;
(3). Cu2O也可能被硝酸氧化为Cu2+,产生“红色固体完全溶解,得蓝色溶液”的现象,所以乙同学认为甲的观点不正确;
(4). 乙醛是非电解质,乙醛溶液不导电,加入Na2SO4溶液的作用是使B池溶液具有导电性,同时保证中性环境,与实验IV-2对比;
(5). 根据控制变量法,实验IV-2中,B池应增大氢氧化钠浓度,并保证乙醛浓度相等,所以B中试剂是:10% NaOH溶液、40%乙醛溶液、蒸馏水按体积比8:1:1混合;
(6)增大氢氧化钠浓度,乙醛的还原性增强,A中CuSO4被还原,乙观察到的现象是:指针偏转,A池中(或A池电极上)生成红色固体;
(7).实验II溶液的碱性大于实验III,实验II能够发生反应的原因还可能有CuSO4在碱性条件下氧化性增强或Cu(OH)2的氧化性强于CuSO4或乙醛缩合反应产物的还原性强于乙醛。

【题目】工业上在恒容密闭容器中用下列反应合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)△H
CH3OH(g)△H
(1)该反应的平衡常数表达式为_______;
(2)如表所列数据是反应在不同温度下的化学平衡常数(K)
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
①由表中数据判断该反应的△H______0(填“>”、“=”或“<”);
②某温度下,将2molCO和6molH2充入2L的密闭容器中,充分反应10s后达到平衡时测得c(CO)=0.2mol/L,则CO的转化率为____,用H2表示反应速率为_____,此时的温度为______;
(3)要提高CO的转化率,可以采取的措施是______;
a.升温 b.加入催化剂 c.增加CO的浓度
d.恒容充入H2 e.恒压充入惰性气体 f.分离出甲醇