题目内容
【题目】【化学—选修3:物质结构与性质】
硼、碳、氮、氟、硫、铁等元素的化合物广泛存在于自然界,回答下列问题:
(1)基态铁原子的外围电子排布式为___________;Fe3+比Fe2+稳定的原因是___________。
(2)第二周期中,元素的第一电离能处于B与N之间的元素有___________种。
(3)NF3是微电子工业中优良的等离子刻蚀气体,NF3分子的空间构型为___________;在NF3中,N原子的杂化轨道类型为___________。
(4)与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为___________,层间作用力为___________。
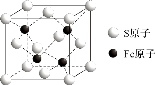
(5)S和Fe形成的某化合物,其晶胞如图所示,则该物质的化学式为___________。假设该晶胞的密度为ρ g/cm3,用NA表示阿伏加德罗常数,则该晶胞中距离最近的S原子之间的距离为(列出计算式即可)___________cm。
【答案】(1)3d64s2;Fe3+的价电子排布为3d5,d轨道处于半充满状态,属于稳定结构;(2)3;(3)三角锥形;sp3;(4)共价键(或极性共价键);范德华力(或分子间作用力);⑸FeS;![]() 。
。
【解析】
试题分析:(1)外围电子指价电子,过渡元素的价电子包括最外层和次外层的d能级上的电子,铁属于26号元素,属于第四周期VIII族元素,因此外围电子排布式为3d64s2;Fe3+的价电子排布式为3d5,Fe2+价电子排布式为3d6,根据洪特规则,处于半满、全满、全空,处于稳定结构,因此原因是:Fe3+的价电子排布为3d5,d轨道处于半充满状态,属于稳定结构;(2)同周期从左向右第一电离能逐渐增大,但IIA>IIIA,VA>VIA,因此在B和N之间有Be、C、O三种;(3)NF3中N有3个σ键,孤电子对数(5-3×1)/2=1,价层电子对数为4,杂化轨道数=价层电子对数,即NF3中N的杂化类型是sp3,空间构型为三角锥形;(4)石墨中层内C和C之间以共价键结合,石墨层层之间以分子间作用力结合,B和N为非金属,B和N之间的化学键为共价键,层间作用力是分子间作用力;(5)根据均摊方法,S原子位于顶点和面上,晶胞中S的个数是8×1/8+6×1/2=4,Fe位于晶胞体内,因此化学式为FeS,设晶胞的边长为a,晶胞的质量为4×88/NAg,晶胞的体积为a3cm3,根据密度的定义,a=![]() ,距离最近的S原子之间的距离是面对角线的一半,即
,距离最近的S原子之间的距离是面对角线的一半,即![]() 。
。