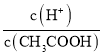题目内容
【题目】下列实验操作不会引起误差的是( )
A.酸碱中和滴定时,用待测液润洗锥形瓶
B.酸碱中和滴定时,用冲洗干净的滴定管盛装标准溶液
C.用NaOH标准溶液测定未知浓度的盐酸溶液时,选用酚酞作指示剂,实验时不小心多加了几滴
D.用标准盐酸测定未知浓度NaOH结束实验时,酸式滴定管尖嘴部分有气泡,开始实验时无气泡
【答案】C
【解析】
用公试c(待测)=![]() 分析误差,主要是对标准液所用体积的影响进行分析。
分析误差,主要是对标准液所用体积的影响进行分析。
A.锥形瓶用蒸馏水洗后,不能用待测润洗,否则待测液的物质的量增加,滴定时标准液所用体积增加,导致测定结果偏大,A项错误;
B.酸碱中和滴定时,滴定管水洗后,直接盛装标准液,标准液的浓度会稀释而降低,为达到终点将待测液反应完毕,滴定时标准液所用体积增加,导致测定结果偏大,故需要先用标准液润洗滴定管,然后再盛装标准溶液,B项错误;
C.在滴定过程中,指示剂略多加了几滴,一般不影响实验结果,因为指示剂不会改变反应过程中酸和碱的物质的量,C项正确;
D.滴定终点时酸式滴定管尖嘴部分有气泡,开始实验时无气泡,可以理解成滴定终点时气泡将使滴定管里的液面上升,标准液的体积减小,导致测定浓度偏低,D项错误;
答案选C。

【题目】某研究小组在电压为24V时进行如下实验,电解3分钟后,发现下列现象。
编号 | ① | ② | ③ |
装置 |
|
|
|
现象 | 小灯泡微弱发光,两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 | 两极均产生气泡,溶液无明显变化 | 两极均产生气泡,阳极附近出现白色浑浊,阴极附近无明显变化 |
下列说法正确的是( )
A.①中小灯泡微亮是因为Ca(OH)2是弱电解质
B.对比①和②,白色浑浊的出现与电极材料无关
C.对比①和③,白色浑浊是由于OH-迁移到阳极使Ca(OH)2沉淀析出
D.阳极附近白色沉淀的成分可能是CaCO3
【题目】硼酸(H3BO3)溶液中存在:H3BO3(aq)+H2O(l)![]() [B(OH)4]-(aq)+H+(aq)。下列说法正确的是
[B(OH)4]-(aq)+H+(aq)。下列说法正确的是
化学式 | 电离常数(298K) |
硼酸 | K=5.7×10-10 |
碳酸 | K1=4.4×10-7 K2=4.7×10-11 |
醋酸 | K=1.75×10-5 |
A.等物质的量浓度的碳酸钠溶液和醋酸钠溶液比较,pH:前者>后者
B.等物质的量浓度的碳酸溶液和硼酸溶液比较,pH:前者>后者
C.将一滴碳酸钠溶液滴入硼酸溶液中一定能观察到有气泡产生
D.将一滴醋酸溶液滴入碳酸钠溶液中一定能观察到有气泡产生