题目内容
16.下列化学用语正确的是( )| A. | HClO的结构式:H-Cl-O | B. | Cl-结构示意图: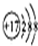 | ||
| C. | CO2的比例模型: | D. | 质量数为23的钠原子:${\;}_{23}^{11}$Na |
分析 A、次氯酸是共价化合物,根据形成稳定结构,氢原子成1个共价键,氧原子成2个共价键,氯原子成1个共价键,即氧原子与氢原子、氯原子分别通过1对共用电子对结合.
B、氯原子得到一个电子后形成最外层8个电子的稳定离子.
C、比例模型就是原子紧密连起的,只能反映原子大小,大致的排列方式.
D、核素表示方法中,左上角为质量数,左下角为质子数.
解答 解:A、次氯酸是共价化合物,氧原子与氢原子、氯原子分别通过1对共用电子对结合,结构式为H-O-Cl,故A错误;
B、Cl最外层为7个电子,得到一个1电子形成氯离子,离子结构示意图为: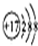 ,故B正确;
,故B正确;
C、由图得出大球为氧原子,中间小球为碳原子.碳与氧处于同一周期,碳元素的核电荷数小,同一周期随核电荷数的增大原子半径减小,所以碳原子半径大于氧原子半径,故C错误;
D、质量数为23的钠原子:${\;}_{11}^{23}Na$,故D错误.故选B.
点评 本题考查化学用语的使用,学生明确原子的最外层电子数及物质的类别、电子式的书写方法是解答本题的关键.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.为提纯下列物质(括号内物质为杂质),所选用的试剂和分离方法都正确的是( )
| 选项 | 物质 | 除杂试剂 | 分离方法或操作 |
| A | 乙醇(水) | 无水CuSO4 | 充分反应后蒸馏 |
| B | 苯(Br2) | NaOH溶液 | 振荡静置后过滤 |
| C | NaCl固体(KNO3) | 水 | 高温溶解、降温结晶 |
| D | BaCO3(BaSO4) | 饱和Na2CO3溶液 | 充分浸泡后过滤 |
| A. | A | B. | B | C. | C | D. | D |
4.下列物质的电子式书写正确的是( )
| A. | 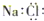 | B. |  | C. | 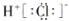 | D. | 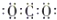 |
11.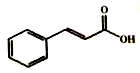 我市盛产荔技、荔枝核中的有机物3-苯基-2-丙烯酸(俗名肉桂酸)含量高达47%,结构如图所示.下列有关说法不正确的是( )
我市盛产荔技、荔枝核中的有机物3-苯基-2-丙烯酸(俗名肉桂酸)含量高达47%,结构如图所示.下列有关说法不正确的是( )
 我市盛产荔技、荔枝核中的有机物3-苯基-2-丙烯酸(俗名肉桂酸)含量高达47%,结构如图所示.下列有关说法不正确的是( )
我市盛产荔技、荔枝核中的有机物3-苯基-2-丙烯酸(俗名肉桂酸)含量高达47%,结构如图所示.下列有关说法不正确的是( )| A. | 肉桂酸可使酸性高锰酸钾溶液褪色 | |
| B. | 肉桂酸能与银氨溶液发生银镜反应 | |
| C. | 肉桂酸分子式为C7H8O2 | |
| D. | 肉桂酸分子中至少有12个原子共平面 |
8.下列化合物中,不含共价键的是( )
| A. | H2O | B. | NaOH | C. | MgCl2 | D. | CO2 |
5.下列叙述正确的是( )
| A. | 价电子排布为4s24p2的元素位于第四周期第ⅤA族,是P区元素 | |
| B. | 1,2-二甲苯核磁共振氢谱中有三组峰,且氢原子数之比为3:1:1 | |
| C. | 钠原子由1s22s22p63s1→1s22s22p63p1时,原子释放能量,由基态转化成激发态 | |
| D. | 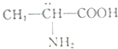 分子属于手性分子 分子属于手性分子 |
14.通常用来衡量一个国家的石油化学工业发展水平的标志是( )
| A. | 石油的年产量 | B. | 硫酸的年产量 | ||
| C. | 合成纤维的年产量 | D. | 乙烯的年产量 |